|
|
|
(10分)硫酸是工业生产中最为重要的产品之一,也是化学工业的重要【化学平衡】
2016-12-26 16:44:46
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (10分)硫酸是工业生产中最为重要的产品之一,也是化学工业的重要原料。
(1)在硫酸工业生产中,我国采用黄铁矿为原料(与氧气反应)生产SO2,进料前必须将黄铁矿粉碎,目的是________。
(2)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是 & #160; 。

(3)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知在T2温度时:2SO2(g)+O2(g)  2SO3(g);△H=-196.6kJ·mol-1, 2SO3(g);△H=-196.6kJ·mol-1,
①在T1温度时,该反应的平衡常数 ,若在此温度下,向10L的恒容密闭容器中,充入0.3 mol SO2(g)、1.6mol O2(g) 和0.3 mol SO3(g),则反应开始时正反应速率 逆反应速率(填“<”、“>”或“=”)。 ,若在此温度下,向10L的恒容密闭容器中,充入0.3 mol SO2(g)、1.6mol O2(g) 和0.3 mol SO3(g),则反应开始时正反应速率 逆反应速率(填“<”、“>”或“=”)。
②在T2温度时,开始在10L的密闭容器中加入4. 0 mol SO2(g)和10mol O2(g),一定条件下当反应达到平衡时共放出热量196.6kJ。此时二氧化硫的转化率为 。
③在②中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原减小的是 (填字母)。
A.保持温度和容器体积不变,充入1mol O2(g)
B.保持温度和容器体积不变,充入2mol SO3 (g)
C.降低温度
D.在其他条件不变时,减小容器的容积
|
填空题 (10分)硫酸是工业生产中最为重要的产品之一,也是化学工业的重要原料。
(1)在硫酸工业生产中,我国采用黄铁矿为原料(与氧气反应)生产SO2,进料前必须将黄铁矿粉碎,目的是________。
(2)实验测得SO2反应生成SO3的转化率与温度、压强有关 ,请根据下表信息,结合工业生产实际,选择最合适的生产条件是 。

(3)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知在T2温度时:2SO2(g)+O2(g)  2SO3(g);△H=-196.6kJ·mol-1, 2SO3(g);△H=-196.6kJ·mol-1,
①在T1温度时,该反应的平衡常数 ,若在此温度下,向10L的恒容密闭容器中,充入0.3 mol SO2(g)、1.6mol O2(g) 和0.3 mol SO3(g),则反应开始时正反应速率 逆反应速率(填“<”、“>”或“=”)。 ,若在此温度下,向10L的恒容密闭容器中,充入0.3 mol SO2(g)、1.6mol O2(g) 和0.3 mol SO3(g),则反应开始时正反应速率 逆反应速率(填“<”、“>”或“=”)。
②在T2温度时,开始在10L的密闭容器中加入4. 0 mol SO2(g)和10mol O2(g),一定条件下当反应达到平衡时共放出热量196.6kJ。此时二氧化硫的转化率为 。
③在②中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原减小的是 (填字母)。
A.保持温度和容器体积不变,充入1mol O2(g)
B.保持温度和容器体积不变,充入2mol SO3 (g)
C.降低温度
D.在其他条件不变时,减小容器的容积
|
本题答案:(1)增大与氧气的接触面积,加快反应速率
(2)400
本题解析:
试题分析:(1)接触面积越大,反应速率越快;(2)温度低二氧化硫的转化率大,增大压强对增大二氧化硫的转化率影响不大,并且增大压强要消耗大量能量、对设备要求高;所以从经济的角度,选择条件为400℃,1大气压;(3)①Q=
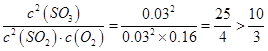
;即Q>K,平衡逆向移动,正反应速率<逆反应速率;②根据2SO2(g)+O2(g)

2SO3(g);△H=-196.6kJ·mol-1,放出196.6kJ的能量,说明生成三氧化硫1mol,则消耗二氧化硫1 mol,所以二氧化硫的转化率为
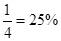
;③保持温度和容器体积不变,充入1mol O2(g),平衡右移,二氧化硫浓度减小;保持温度和容器体积不变,充入2mol SO3 (g),平衡左移,二氧化硫浓度增大;降低温度,平衡右移,二氧化硫浓度减小;在其他条件不变时,减小容器的容积,二氧化硫浓度增大。
考点:本题考查反应速率、平衡移动原理。
本题所属考点:【化学平衡】
本题难易程度:【一般】
They have rights who dare defend them. 敢于保卫权利的人就能拥有权利。
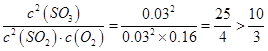 ;即Q>K,平衡逆向移动,正反应速率<逆反应速率;②根据2SO2(g)+O2(g)
;即Q>K,平衡逆向移动,正反应速率<逆反应速率;②根据2SO2(g)+O2(g)  2SO3(g);△H=-196.6kJ·mol-1,放出196.6kJ的能量,说明生成三氧化硫1mol,则消耗二氧化硫1 mol,所以二氧化硫的转化率为
2SO3(g);△H=-196.6kJ·mol-1,放出196.6kJ的能量,说明生成三氧化硫1mol,则消耗二氧化硫1 mol,所以二氧化硫的转化率为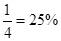 ;③保持温度和容器体积不变,充入1mol O2(g),平衡右移,二氧化硫浓度减小;保持温度和容器体积不变,充入2mol SO3 (g),平衡左移,二氧化硫浓度增大;降低温度,平衡右移,二氧化硫浓度减小;在其他条件不变时,减小容器的容积,二氧化硫浓度增大。
;③保持温度和容器体积不变,充入1mol O2(g),平衡右移,二氧化硫浓度减小;保持温度和容器体积不变,充入2mol SO3 (g),平衡左移,二氧化硫浓度增大;降低温度,平衡右移,二氧化硫浓度减小;在其他条件不变时,减小容器的容积,二氧化硫浓度增大。