微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (16分)Ⅰ.苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)  C8H8(g)+H2(g)ΔH=120 kJ·mol-1。某温度下,将0.40 mol苯乙烷,充入2 L真空密闭容器中发生反应,
C8H8(g)+H2(g)ΔH=120 kJ·mol-1。某温度下,将0.40 mol苯乙烷,充入2 L真空密闭容器中发生反应,
测定不同时间该容器内气体物质的量,得到数据如下表:
时间/min
| 0
| 10
| 20
| 30
| 40
|
n(C8H10)/mol
| 0.40
| 0.30
| 0.24
| n2
| n3
|
n(C8H8)/mol
| 0.00
| 0.10
| n1
| 0.20
| 0.20
|
(1)当反应进行到20 min时,该段时间内H2的平均反应速率是_____ ___。
(2)该温度下,该反应的化学平衡常数是________ ________。
(3)若保持其他条件不变,用0.50 mol H2(g)和0.50 mol C8H8(g)合成C8H10(g),当有30 kJ热量放出时,该反应中H2的转化率是________________。此时,该合成反应是否达到了平衡状态?________(填“是”或“否”),且正反应速率 逆反应速率(填大于、小于或等于)
(4)对于反应C8H10(g)  C8H8(g)+H2(g),下列说法正确的是
C8H8(g)+H2(g),下列说法正确的是
A、恒温恒容条件下C8H10(g)和C8H8(g)生成速率相等能说明该反应达到平衡状态
B、压强增大该反应的平衡常数也增大
C、在恒温恒压条件下,有2 mol C8H10(g)在容器中完全反应,该反应的反应热为ΔH1,另有4 mol C8H10(g)在容器中完全反应,该反应的反应热为ΔH2,则ΔH2=2ΔH1
Ⅱ.在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)  2NH3(g) ΔH<0,反应中NH3的物质的量浓度的变化情况如下图:
2NH3(g) ΔH<0,反应中NH3的物质的量浓度的变化情况如下图:
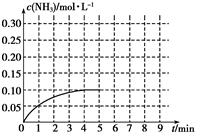
(1)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为________。
①0.20 mol·L-1 ②0.12 mol·L-1 ③0.10 mol·L-1 ④0.08 mol·L-1
(2)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末达到此平衡时NH3浓度的变化曲线。
填空题 (16分)Ⅰ.苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)  C8H8(g)+H2(g)ΔH=120 kJ·mol-1。某温度下,将 0.40 mol苯乙烷,充入2 L真空密闭容器中发生反应,
C8H8(g)+H2(g)ΔH=120 kJ·mol-1。某温度下,将 0.40 mol苯乙烷,充入2 L真空密闭容器中发生反应,
测定不同时间该容器内气体物质的量,得到数据如下表:
时间/min
| 0
| 10
| 20
| 30
| 40
|
n(C8H10)/mol
| 0.40
| 0.30
| 0.24
| n2
| n3
|
n(C8H8)/mol
| 0.00
| 0.10
| n1
| 0.20
| 0.20
|
(1)当反应进行到20 min时,该段时间内H2的平均反应速率是_____ ___。
(2)该温度下,该反应的化学平衡常数是________ ________。
(3)若保持其他条件不变,用0.50 mol H2(g)和0.50 mol C8H8(g)合成C8H10(g),当有30 kJ热量放出时,该反应中H2的转化率是________________。此时,该合成反应是否达到了平衡状态?________(填“是”或“否”),且正反应速率 逆反应速率(填大于、小于或等于)
(4)对于反应C8H10(g)  C8H8(g)+H2(g),下列说法正确的是
C8H8(g)+H2(g),下列说法正确的是
A、恒温恒容条件下C8H10(g)和C8H8(g)生成速率相等能说明该反应达到平衡状态
B、压强增大该反应的平衡常数也增大
C、在恒温恒压条件下,有2 mol C8H10(g)在容器中完全反应,该反应的反应热为ΔH1,另有4 mol C8H10(g)在容器中完全反应,该反应的反应热为ΔH2,则ΔH2=2ΔH1
Ⅱ.在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)  2NH3(g) ΔH<0,反应中NH3的物质的量浓度的变化情况如下图:
2NH3(g) ΔH<0,反应中NH3的物质的量浓度的变化情况如下图:

(1)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为________。
①0.20 mol·L-1 ②0.12 mol·L-1 ③0.10 mol·L-1 ④0.08 mol·L-1
(2)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末达到此平衡时NH3浓度的变化曲线。
本题答案:Ⅰ、(1)0.004 mol·L-1·min-1
本题解析:
试题解析:Ⅰ.(1)20min时,C8H10的物质的量为0.24mol,变化的物质的量为0.40mol-0.24mol=0.16mol,根据方程式C8H10(g) C8H8(g)+H2(g)可知,生成C8H80.14mol,则:
C8H8(g)+H2(g)可知,生成C8H80.14mol,则:
C8H10(g) C8H8(g)+H2(g)
C8H8(g)+H2(g)
起始:0.40mol 0 0
转化: 0.16mo 0.16mol 0.16mol
20min: 0.24mol 0.16mol 0.16mol
20min时:c(H2)=0.08mol/L,v(H2)=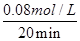 ="0.004" mol·L-1·min-1;
="0.004" mol·L-1·min-1;
(2)30min时反应建立平衡,n(C8H8)=0.20mol,则:
C8H10(g) C8H8(g)+H2(g)
C8H8(g)+H2(g)
起始: 0.40mol 0 0
转化: 0.20mo 0.20mol 0.20mol
30min: 0.20mol 0.20mol 0.20mol
平衡状态下,c(C8H10)=0.1mol/L,c(C8H8)=0.1mol/L,c(H2)=0.1mol/L,k=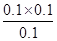 =0.1;
=0.1;
(3)原反应的逆反应为:C8H8(g)+H2(g) C8H10(g) ΔH=-120 kJ·mol-1,平衡常数K逆=
C8H10(g) ΔH=-120 kJ·mol-1,平衡常数K逆=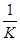 =10。反应放出30 kJ热量时,消耗0.25mol氢气,则:
=10。反应放出30 kJ热量时,消耗0.25mol氢气,则:
C8H8(g)+H2(g) C8H10(g)
C8H10(g)
起始:0.50mol 0.50mol 0
转化:0.25mol 0.25mol 0.25mol
末态:0.25mol 0.25mol 0.25mol
氢气的转化率=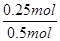 ×100%=50%;c(C8H10)=0.125mol/L,c(C8H8)=0.125mol/L,c(H2)=0.125mol/L,Qc=
×100%=50%;c(C8H10)=0.125mol/L,c(C8H8)=0.125mol/L,c(H2)=0.125mol/L,Qc=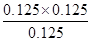 =0.125<K逆,故反应没有达到平衡状态,且正在向正向进行,故正反应速率大于逆反应速率;(4)C8H10(g)和C8H8(g)生成速率相等,说明正逆反应速率相等,该反应达到平衡状态,故A正确;平衡常数只受温度影响,不受压强影响,故B错误;ΔH与反应物的用量无关,故C错误;故选A;Ⅱ.(1)5分钟末,氨气的浓度为0.1mol/L,改变温度,平衡发生移动,氨气浓度肯能增大,也可能减小,但因为氮气和氢气不能完全反应,氨气浓度不可能达到0.2mol/L,故选①③;(2)在第5分钟末将容器的体积缩小一半,氨气浓度变为0.2mol/L,此后平衡向正向移动,氨气浓度又逐渐增大,至8分钟末达到新的平衡时等于0.25 mol·L-1,故图像为:
=0.125<K逆,故反应没有达到平衡状态,且正在向正向进行,故正反应速率大于逆反应速率;(4)C8H10(g)和C8H8(g)生成速率相等,说明正逆反应速率相等,该反应达到平衡状态,故A正确;平衡常数只受温度影响,不受压强影响,故B错误;ΔH与反应物的用量无关,故C错误;故选A;Ⅱ.(1)5分钟末,氨气的浓度为0.1mol/L,改变温度,平衡发生移动,氨气浓度肯能增大,也可能减小,但因为氮气和氢气不能完全反应,氨气浓度不可能达到0.2mol/L,故选①③;(2)在第5分钟末将容器的体积缩小一半,氨气浓度变为0.2mol/L,此后平衡向正向移动,氨气浓度又逐渐增大,至8分钟末达到新的平衡时等于0.25 mol·L-1,故图像为:
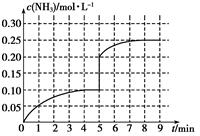 。
。
考点:化学反应速率、化学平衡移动、化学平衡常数
本题所属考点:【化学平衡】
本题难易程度:【困难】
Glory is the shadow of virtue. 荣誉是美德的影子.