微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (8分)某温度下在容积固定的密闭容器中,下列反应达到平衡:
CO(g)+H2O(g) 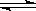 CO2(g)+H2(g)
CO2(g)+H2(g)
初始投料比n(CO):n(H2O)
| CO转化率
| H2O转化率
|
1:1
| 0.5
| 0.5
|
1:2
| 0.67
| 0.335
|
1:3
| 0.75
| 0.25
|
(1)已知CO和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H= -44kJ/mol,写出CO(g)和H2O(g)反应的热化学方程式 。
(2)该反应的平衡常数为 。该温度下,向该容器中充入1mol CO、3molH2O(g)、2mol CO2、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
(3)结合表中数据判断下列说法中正确的是 。
A.增加H2O(g)的量,CO的转化率升高而H2O(g)的转化率降低
B.若CO与H2O(g)的转化率相同,则二者的初始投入量一定相同
C.CO和H2O(g)初始物质的量之比等于二者转化率之比
D.当CO与H2O(g)物质的量之比为1:4时,CO的转化率为0.85
填空题 (8分)某温度下在容积固定的密闭容器中,下列反应达到平衡:
CO(g)+H2O(g) 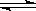 CO2(g)+H2(g)
CO2(g)+H2(g)
初始投料比n(CO):n(H2O)
| CO转化率
| H2O转化率
|
1:1
| 0.5
| 0.5
|
1:2
| 0.67
| 0.335
|
1:3
| 0.75
| 0.25
|
(1)已知CO和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H= -44kJ/mol,写出CO(g)和H2O(g)反应的热化学方程式 &# 91exam.org160; 。
(2)该反应的平衡常数为 。该温度下,向该容器中充入1mol CO、3molH2O(g)、2mol CO2、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
(3)结合表中数据判断下列说法中正确的是 。
A.增加H2O(g)的量,CO的转化率升高而H2O(g)的转化率降低
B.若CO与H2O(g)的转化率相同,则二者的初始投入量一定相同
C.CO和H2O(g)初始物质的量之比等于二者转化率之比
D.当CO与H2O(g)物质的量之比为1:4时,CO的转化率为0.85
本题答案:(1)CO(g)+H2O(g)已知CO和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,则CO(g)+1/2O2(g)=CO2(g)△H=-283kJ/mol;H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ/mol;H2O(g)=H2O(l)△H= -44kJ/mol,①式+③式-②式得CO(g)+H2O(g)<img onload='if(this.width>600)makesmallpic(this,600,1800);' src=) CO2(g)+H2(g)△H=-41.2kJ/mol,故答案为CO(g)+H2O(g)
CO2(g)+H2(g)△H=-41.2kJ/mol,故答案为CO(g)+H2O(g)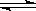 CO2(g)+H2(g)△H=-41.2kJ/mol(2)若初始投料比为1:1,则CO的转化率为0.5,平衡常数K=
CO2(g)+H2(g)△H=-41.2kJ/mol(2)若初始投料比为1:1,则CO的转化率为0.5,平衡常数K=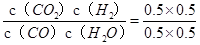 =1,向该容器中充入1mol CO、3molH2O(g)、2mol CO2、1.5molH2,,则Qc=
=1,向该容器中充入1mol CO、3molH2O(g)、2mol CO2、1.5molH2,,则Qc= =1,V正=V逆.(3)A.增加H2O(g)的量,是平衡向正反应方向移动,CO的转化率增大,水的转化率降低,A正确;B.CO与H2O(g)的计量数相等,若CO与H2O(g)的转化率相同,则二者的初始投入量一定相同,B正确;CO和H2O(g)始终按照系数比转化,即按照1:1进行转化,但初始的物质的量不一定按1:1进行投料,C错误;CO(g)+H2O(g)
=1,V正=V逆.(3)A.增加H2O(g)的量,是平衡向正反应方向移动,CO的转化率增大,水的转化率降低,A正确;B.CO与H2O(g)的计量数相等,若CO与H2O(g)的转化率相同,则二者的初始投入量一定相同,B正确;CO和H2O(g)始终按照系数比转化,即按照1:1进行转化,但初始的物质的量不一定按1:1进行投料,C错误;CO(g)+H2O(g) CO2(g)+H2(g)假设一氧化碳转化率为x,则CO转了xmol,二氧化碳和氢气分别生成(1-x),由平衡常数K=1=
CO2(g)+H2(g)假设一氧化碳转化率为x,则CO转了xmol,二氧化碳和氢气分别生成(1-x),由平衡常数K=1= ,解得x=0.8,即转化率为80%,D错误;答案选AB.
,解得x=0.8,即转化率为80%,D错误;答案选AB.
考点:化学平衡常数的有关计算
本题所属考点:【化学平衡】
本题难易程度:【一般】
The supreme happiness of life is the conviction that we are loved. 生活中最大的幸福是坚信有人爱我们.