微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (11分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用以下反应可处理NO2:6NO2+8NH3 7N2+12H2O ΔH< 0。请在答题卡的坐标图中, 91exam .org画出上述反应在有催化剂和无催化剂两种情况下反应过程中体系能量变化的示意图,并标明反应热。
7N2+12H2O ΔH< 0。请在答题卡的坐标图中, 91exam .org画出上述反应在有催化剂和无催化剂两种情况下反应过程中体系能量变化的示意图,并标明反应热。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH =-196.6 kJ·mol-1
2SO3(g) ΔH =-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH =-113.0 kJ·mol-1
2NO2(g) ΔH =-113.0 kJ·mol-1
写出1mol SO2与足量NO2反应转变成SO3(g)的热化学方程式 。
(3)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________________。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=_____(结果取三位有效数字)。
填空题 (11分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用以下反应可处理NO2:6NO2+8NH3 7N2+12H2O ΔH< 0。请在答题卡的坐标图中,画出上述反应在有催化剂和无催化剂两种情况下反应过程中体系能量变化的示意图,并标明反应热。
7N2+12H2O ΔH< 0。请在答题卡的坐标图中,画出上述反应在有催化剂和无催化剂两种情况下反应过程中体系能量变化的示意图,并标明反应热。

(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH =-196.6 kJ·mol-1
2SO3(g) ΔH =-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH =-113.0 kJ·mol-1
2NO2(g) ΔH =-113.0 kJ·mol-1
写出1mol SO2与足量NO2反应转变成SO3(g)的热化学方程式 。
(3)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应 ,下列能说明反应达到平衡状态的是__________________。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=_____(结果取三位有效数字)。
本题答案:(1)该反应为放热反应,反应物总能量小于生成物总能量,催化剂能降低反应的活化能,使化学反应速率加快,但不能使平衡移动,不影响反应热,因此作图如下:<br><img onload='if(this.width>600)makesmallpic(this,600,1800);' src=)
(2)先以1mol SO2与足量NO2反应写出反应方程式:NO2+SO2 SO3+NO,根据盖斯定律,将第二个方程式颠倒过来,与第一个方程式相加,再把结果除以2得: NO2(g)+SO2(g)
SO3+NO,根据盖斯定律,将第二个方程式颠倒过来,与第一个方程式相加,再把结果除以2得: NO2(g)+SO2(g) SO3(g)+NO(g),△H=-
SO3(g)+NO(g),△H=-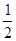 (-113.0 kJ·mol-1)+
(-113.0 kJ·mol-1)+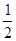 (-196.6 kJ·mol-1)=—83.6 kJ·mol-1,故NO2(g)+SO2(g)
(-196.6 kJ·mol-1)=—83.6 kJ·mol-1,故NO2(g)+SO2(g) SO3(g)+NO(g) △H="-41.8" kJ·mol-1;
SO3(g)+NO(g) △H="-41.8" kJ·mol-1;
(3)本反应是反应前后气体分子数不变的反应,故体系的压强保持不变,故a不能说明反应已达到平衡状态;随着反应的进行,NO2的浓度减小,颜色变浅,故b可以说明反应已达平衡;SO3和NO都是生成物,比例保持1:1,故c不能作为平衡状态的判断依据;d中所述的两个速率都是逆反应速率,不能作为平衡状态的判断依据。
NO2(g)+SO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
起始物质的体积 1a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 1a-x 2a-x x x
则(1a-x):(2a-x)=1:6,故x=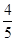 a,故平衡常数为:
a,故平衡常数为: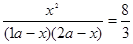 =2.67。
=2.67。
考点:考查化学平衡、盖斯定律的应用及平衡常数的计算。
本题所属考点:【化学平衡】
本题难易程度:【困难】
Time is life. 时间就是生命.