微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (16分)(一)某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,通过测定褪色所需时间来判断反应的快慢。限选试剂与仪器:0.20mol/LH2C2O4溶液,0.010mol/L 酸性KMnO4溶液,蒸馏水,锥形瓶,恒温水浴槽,量筒,秒表。该小组设计了如下的方案。
物理量
|
| H2C2O4溶液
| 酸性KMnO4溶液
| 温度/℃
|
| 浓度/mol·L-1
| 体积/mL
| 浓度/mol·L-1
| 体积/mL
|
①
| 0
| 0.20
| 2.0
| 0.010
| 4.0
| 50
|
②
| 0
| 0.20
| 2.0
| 0.010
| 4.0
| 25
|
③
|
|
|
| 0.010
| 4.0
| 25
|
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4):n (KMnO4) ≥_______。
(2)请完成表格内五处空白。
(3)实验③测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v( KMnO4)=______________mol·L-1·min-1。
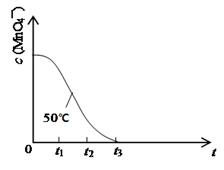
(4)已知50℃时c(MnO4—)~反应时间t的变化曲线如下图。其中反应速率最快的阶段是_____,原因是 。
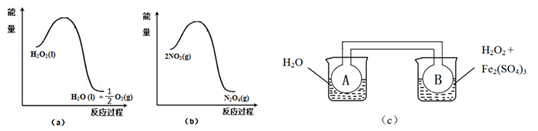
(二)利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是_________________________。
填空题 (16分)(一)某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,通过测定褪色所需时间来判断反应的快慢。限选试剂与仪器:0.20mol/LH2C2O4溶液,0.010mol/L 酸性KMnO4溶液,蒸馏水,锥形瓶,恒温水浴槽,量筒,秒表。该小组设计了如下的方案。
物理量
|
| H2C2O4溶液
| 酸性KMnO4溶液
| 温度/℃
|
| 浓度/mol·L-1
| 体积/mL
| 浓度/mol·L-1
| 体积/mL
|
①
| 0
| 0.20
| 2.0
| 0.010
| 4.0
| 50
|
②
| 0
| 0.20
| 2.0
| 0.010
| 4.0
| 25
|
③
|
|
|
| 0.010
| 4.0
| 25
|
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4):n (KMnO4) ≥_______。
(2)请完成表格内五处空白。
(3)实验③测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=______________mol·L-1·min-1。
(4)已知50℃时c(MnO4—)~反应时间t的变化曲线如下图。其中反应速率最快的阶段是_____,原因是 。

(二)利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是_________________________。

本题答案:(一)(1)2:5或2.5;(2)
物理量
蒸馏
本题解析:
试题分析:(一)(1)根据反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,利用化合价升降相等写者 出反应的化学方程式为:
2KMnO4+5H2C2O4 +3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑;为了观察到紫色褪去,高锰酸钾的物质的量应该少量,即c(H2C2O4):c(KMnO4)≥5:2=2.5,
故答案为:2:5或2.5;
(2)①和②除了温度不同,其他条件完全相同,是探究温度对化学反应速率影响;题干中只提供一种浓度的草酸,则只能在溶液总体积相等的情况下用蒸馏水将其调节成不同浓度,则设计五个空格的答案为:
物理量
蒸馏水
H2C2O4溶液
酸性KMnO4溶液
温度/℃
体积/mL
浓度/mol·L-1
体积/mL
浓度/mol·L-1
体积/mL
①
0
0.20
2.0
0.010
4.0
50
②
0
0.20
2.0
0.010
4.0
25
③
1.0
0.20
1.0
0.010
4.0
25
(3)草酸的物质的量为:0.10mol?L-1×0.002L=0.0002mol,高锰酸钾的物质的量为:0.010mol?L-1×0.004L=0.00004mol,草酸和高锰酸钾的物质的量之比为:0.0002mol:0.00004mol=5:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为: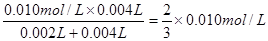 ,这段时间内平均反应速率v(KMnO4)=
,这段时间内平均反应速率v(KMnO4)=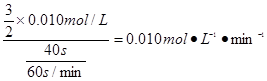 ,故答案为:0.010或1.0×10-2;
,故答案为:0.010或1.0×10-2;
(4)根据图中可知在o-t1,t1-t2,t2-t3,三段中c(KMnO4)的变化最大的是t1-t2, 故反应速率最快的阶段是t1-t2,原因是:随着反应2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑的进行研究,产生的MnSO4作为反应的催化剂使反应速率加快。
(二)(2)由图(a)可得热化学方程式H2O2(l)= H2O(l)+ O2(g) ΔH<0,2NO2(g)
O2(g) ΔH<0,2NO2(g) N2O4(g) ΔH<0。由于H2O2的分解反应为放热反应[注意Fe2(SO4)3作催化剂],故右边烧杯中液体温度高于左边烧杯中液体温度,则B瓶中气体的温度高于A瓶中气体的温度,升高温度,2NO2(g)
N2O4(g) ΔH<0。由于H2O2的分解反应为放热反应[注意Fe2(SO4)3作催化剂],故右边烧杯中液体温度高于左边烧杯中液体温度,则B瓶中气体的温度高于A瓶中气体的温度,升高温度,2NO2(g) N2O4(g)的平衡逆向移动,c(NO2)增大,混合气体颜色加深。故答案为:深 据图(a)可知,H2O2分解放热,使得B瓶中温度升高,据图(b)可知,2NO2(g)
N2O4(g)的平衡逆向移动,c(NO2)增大,混合气体颜色加深。故答案为:深 据图(a)可知,H2O2分解放热,使得B瓶中温度升高,据图(b)可知,2NO2(g) N2O4(g)为放热反应,温度升高,平衡逆向移动,从而使NO2浓度增大,颜色加深。
N2O4(g)为放热反应,温度升高,平衡逆向移动,从而使NO2浓度增大,颜色加深。
考点:考查化学反应速率和化学平衡的影响因素。
本题所属考点:【化学平衡】
本题难易程度:【困难】
No one but the wearer knows where the shoe pinches. 穿鞋的人自己知道哪儿夹脚。