微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 硫酸工业中接触氧化是最重要的一个反应:2SO2(g) + O2(g)  2SO3(g) △H= -197kJ/mol。为了研究这一反应,在体积为2L的密闭容积中,投入2mol SO2,1molO2,然后控制反应温度,在反应进行至20min时加入一定的催化剂,测定并记录一定时间内容器内SO3的物质的量,得到下表:
2SO3(g) △H= -197kJ/mol。为了研究这一反应,在体积为2L的密闭容积中,投入2mol SO2,1molO2,然后控制反应温度,在反应进行至20min时加入一定的催化剂,测定并记录一定时间内容器内SO3的物质的量,得到下表:
时间/min
| 10
| 20
| 30
| 40
| 50
|
N(SO3)/mol
| 0.4
|
0.6
| 1.2
| 1.6
| 1.6
|
(1)反应前10 min,用O2表示该反应的反应速率v(O2)= 。
(2)该温度下,该反应的平衡常数为 。
(3)在反应进行至50min时,再向容器中充入2molSO2和1molO2,达到新平衡后,SO2的转化率将 。(填“增大”、“减小”或“不变”)
(4)保持温度不变,若在该容器中只投入2mol SO3,达到平衡时,反应吸收的热量为 kJ。
填空题 硫酸工业中接触氧化是最重要的一个反应:2SO2(g) + O2(g)  2SO3(g) △H= -197kJ/mol。为了研究这一反应,在体积为2L的密闭容积中,投入2mol SO2 ,1molO2,然后控制反应温度,在反应进行至20min时加入一定的催化剂,测定并记录一定时间内容器内SO3的物质的量,得到下表:
2SO3(g) △H= -197kJ/mol。为了研究这一反应,在体积为2L的密闭容积中,投入2mol SO2 ,1molO2,然后控制反应温度,在反应进行至20min时加入一定的催化剂,测定并记录一定时间内容器内SO3的物质的量,得到下表:
时间/min
| 10
| 20
| 30
| 40
| 50
|
N(SO3)/mol
| 0.4
|
0.6
| 1.2
| 1.6
| 1.6
|
(1)反应前10 min,用O2表示该反应的反应速率v(O2)= 。
(2)该温度下,该反应的平衡常数为 。
(3)在反应进行至50min时,再向容器中充入2molSO2和1molO2,达到新平衡后,SO2的转化率将 。(填“增大”、“减小”或“不变”)
(4)保持温度不变,若在该容器中只投入2mol SO3,达到平衡时,反应吸收的热量为 kJ。
本题答案:(1)0.01mol/(L·min) (2)160
本题解析:
试题解析:(1)反应前10 min,用SO3表示该反应的反应速率v(SO2)=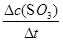 =
=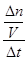 =
=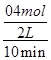 =0.02mol/(L·min),利用速率之比等于计量系数比可知,v(O2)=
=0.02mol/(L·min),利用速率之比等于计量系数比可知,v(O2)=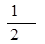 v(SO2)=0.01mol/(L·min);(2)由表中数据可知,40分钟达到平衡,则可逆反应: 2SO2(g) + O2(g)
v(SO2)=0.01mol/(L·min);(2)由表中数据可知,40分钟达到平衡,则可逆反应: 2SO2(g) + O2(g) 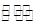 2SO3(g)
2SO3(g)
起始浓度(mol/L) : 1 0.5 0
变化浓度(mol/L) :0.8 0.4 0.8
平衡浓度(mol/L) :0.2 0.1 0.8
该反应的平衡常数K=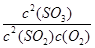 =
=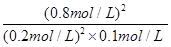 =160;(3)在反应进行至50min时,再向容器中充入2molSO2和1molO2,在体积不变的条件下,物质的量同时扩大1倍,相当于增大压强,平衡向正反应方向移动,达到新平衡后,SO2的转化率将增大;(4)保持温度不变,若在该容器中只投入2mol SO3,与上述可逆反应相比较,相当于由逆反应建立平衡,两者是等效的,达平衡时 SO3的浓度为0.8mol/L,转化的浓度=1mol/L-0.8mol/L=0.2mol/L,则SO3的转化率=
=160;(3)在反应进行至50min时,再向容器中充入2molSO2和1molO2,在体积不变的条件下,物质的量同时扩大1倍,相当于增大压强,平衡向正反应方向移动,达到新平衡后,SO2的转化率将增大;(4)保持温度不变,若在该容器中只投入2mol SO3,与上述可逆反应相比较,相当于由逆反应建立平衡,两者是等效的,达平衡时 SO3的浓度为0.8mol/L,转化的浓度=1mol/L-0.8mol/L=0.2mol/L,则SO3的转化率=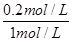 =20%,反应吸收的热量为197kJ/mol×20%=39.4KJ。
=20%,反应吸收的热量为197kJ/mol×20%=39.4KJ。
考点:化学反应速率、化学平衡
本题所属考点:【化学平衡】
本题难易程度:【一般】
Language is the dress of thought. 语言是思想的衣服。