微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 红磷P(s)和Cl2(g)发生反应,生成PCl3(g)和PCl5(g)。反应过程和能量的关系如图所示(图中△H表示生成1 mol 产物的数据)。
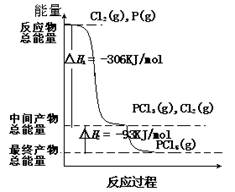
根据图回答下列问题:
(1)P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式: 91EXAm.org
(2)PCl5(g)分解生成PCl3(g)和Cl2(g)的热化学方程式:____________________;
(3)上述分解反应是一个可逆反应。温度T1时,在体积为1L的密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60mol,其分解率α1等于 ,平衡常数K1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,平衡常数为K2,则α2 α1,
K2 K1。(填“大于”、“小于”或“等于”)
(4)P和Cl2分两步反应生成1mol PCl5的△H3 =
填空题 红磷P(s)和Cl2(g)发生反应,生成PCl3(g)和PCl5(g)。反应过程和能量的关系如图所示(图中△H表示生成1 mol 产物的数据)。

根据图回答下列问题:
(1)P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式:
(2)PCl5(g)分解生成PCl3(g)和Cl2(g)的热化学方程式:____________________;
(3)上述分解反应是一个可逆反应。温度T1时,在体积为1L的密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60mol,其分解率α1等于 ,平衡常数K1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,平衡常数为K2,则α2 α1,
K2 K1。(填“大于”、“小于”或“等于”)
(4)P和Cl2分两步反应生成1mol PCl5的△H3 =
本题答案:(每空2分)
(1)P(s) + 3/2 Cl 2(g)
本题解析:
试题分析:(1)热化学方程式书写要求:注明各物质的聚集状态,判断放热反应还是吸热反应,反应物的物质的量与反应热成对应的比例关系,根据图示P(s)+Cl2(g)→PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H="-306" kJ/mol,热化学方程式为:P(s)+3/2Cl2(g)
本题所属考点:【化学平衡】
本题难易程度:【一般】
Can man be free if woman is a slave? 妇女当牛做马,男子焉能自由?