微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (16分)碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液,生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g)+ CH3OCOOCH3(g) 2 CH3OCOOC2H5(g) ΔH1
2 CH3OCOOC2H5(g) ΔH1
(1)其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R)的关系如图所示。
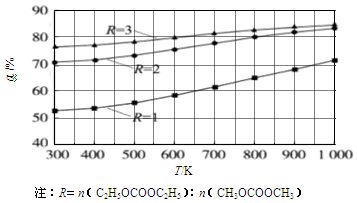
①ΔH1______0(填“<”、“=”或“>”)。
②由图可知,为了提高CH3OCOOCH3的平衡转化率,除了升温,另一措施是___________。
③在密闭容器中,将1mol C2H5OCOOC2H5和1mol CH3OCOOCH3混合加热到650K,利用图中的数据,求此温度下该反应的平衡常数K(请写出计算过程)。
(2)已知:CH3OCOOCH3(g) + C2H5OH(g) CH3OCOOC2H5(g) + CH3OH(g) ΔH2
CH3OCOOC2H5(g) + CH3OH(g) ΔH2
CH3OCOOC2H5(g) + C 2H5OH(g) C2H5OCOOC2H5(g) + CH3OH(g) ΔH3
C2H5OCOOC2H5(g) + CH3OH(g) ΔH3
ΔH1=____________________(用ΔH2和ΔH3表示)
(3)已知上述反应需要催化剂,请在答题卡的坐标图中,画出有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
填空题 (16分)碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液,生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g)+ CH3OCOOCH3(g) 2 CH3OCOOC2H5(g) ΔH1
2 CH3OCOOC2H5(g) ΔH1
(1)其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R)的关系如图所示。

①ΔH1______0(填“<”、“=”或“>”)。
②由图可知,为了提高CH3OCOOCH3的平衡转化率,除了升温,另一措施是___________。
③在密闭容器中,将1mol C2H5OCOOC2H5和1mol CH3OCOOCH3混合加热到650K,利用图中的数据,求此温度下该反应的平衡常数K(请写出计算过程)。
(2)已知:CH3OCOOCH3(g) + C2H5OH(g) CH3OCOOC2H5(g) + CH3OH(g) ΔH2
CH3OCOOC2H5(g) + CH3OH(g) ΔH2
CH3OCOOC2H5(g) + C2H5OH(g) C2H5OCOOC2H5(g) + CH3OH(g) ΔH3
C2H5OCOOC2H5(g) + CH3OH(g) ΔH3
ΔH1=____________________(用ΔH2和ΔH3表示)
(3)已知上述反应需要催化剂,请在答题卡的坐标图中,画出有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
本题答案:(1)① >(2分)② 增大反应物中C2H5OCOOC2H5
本题解析:
试题分析:(1)①根据图像变化可知,在反应物配比相同的条件下,温度越高,CH3OCOOCH3的平衡转化率越大,这说明升高温度平衡向正反应方向进行,因此该反应的正反应为吸热反应,即△H>0;
②根据图像变化可知,在温度相同的条件下,R越大,CH3OCOOCH3的平衡转化率越大,因此除升温外,还可增大反应物中C2H5OCOOC2H5的浓度(或比例);
③由图知,R=1,650K,达到平衡时CH3OCOOCH3的转化率为60%。设容器的容积为V(L),则
C2H5OCOOC2H5(g)+ CH3OCOOCH3(g) 2CH3OCOOC2H5(g)
2CH3OCOOC2H5(g)
初始浓度/ mol·L-1: 1/V 1/V 0
平衡浓度/ mol·L-1: 0.4/V 0.4/V   1.2/V
所以该温度下平衡常数K=
(2)已知①CH3OCOOCH3(g)+C2H5OH(g) CH3OCOOC2H5(g)+CH3OH(g)△H2,②CH3OCOOC2H5(g)+C2H5OH(g)
CH3OCOOC2H5(g)+CH3OH(g)△H2,②CH3OCOOC2H5(g)+C2H5OH(g) C2H5OCOOC2H5(g)+CH3OH(g)△H3,则根据盖斯定律可知,①-②可得C2H5OCOOC2H5(g)+CH3OCOOCH3(g)
C2H5OCOOC2H5(g)+CH3OH(g)△H3,则根据盖斯定律可知,①-②可得C2H5OCOOC2H5(g)+CH3OCOOCH3(g) 2CH3OCOOC2H5(g),所以反应热△H1=△H2-△H3;
2CH3OCOOC2H5(g),所以反应热△H1=△H2-△H3;
(3)催化剂不影响平衡状态和反应热,但催化剂降低反应所需的活化能,即可反应速率,因此有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图可表示为
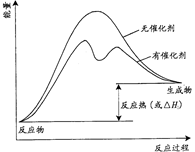 。
。
考点:考查外界条件对平衡状态的影响、化学平衡图像分析以及平衡状态和反应热的有关计算等
本题所属考点:【化学平衡】
本题难易程度:【困难】
He that plants trees loves others besides himself. 植树的人,不但爱已,而且爱人.