微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
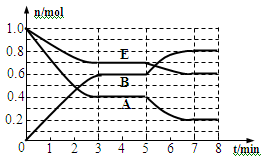
填空题 (本题共11分)本题有2小题。在一体积为2L的密闭容器中,气态物质A、B、E的物质的量n随时间t的变化如图所示。已知达到平衡后,降低温度A的转化率增大。
29、写出此反应的化学方程式_________________________________;此反应是___________热反应。
30、根据图数据,从反应开始到第一次达到平衡时平均速率v (E)为________________。
31、在5~7 min内曲线变化的原因可能是____(填编号)
A. 降低了温度 & #160; B. 使用了催化剂
C. 减小了容器的体积 D. 减少了A的物质的量
32、设该反应达到平衡时的平衡常数为K1,保持温度不变,将容器体积减少一半,达到新的平衡后,测得B的平衡浓度为原来的2.2倍,平衡常数为K2,则_______(填编号)
A. 平衡向正反应方向移动,且K2 > K1
B. 平衡移动过程中,正反应速率大于逆反应速率
C. 达到新平衡时,A的浓度增大,且K1 > K2
D. 达到新平衡时,E的浓度是原来的2倍多,且K1 = K2
已知在25℃时,亚硝酸、次氯酸和氢硫酸的电离常数分别为:
亚硝酸 Ki = 4.6×10-4
次氯酸 Ki = 3.0×10-8
氢硫酸 Ki 1= 9.1×10-8 Ki 2 = 1.1×10-12
33、写出氢硫酸的第一级电离平衡常数表达式:Ki1 = _________________。
34、在相同条件下,试比较H2S、HS-、HClO和HNO2的酸性强弱:______>______>_____>_______。
35、保持温度不变,在氢硫酸溶液中加入少量盐酸,下列量会变小的是_____(填序号)
A.c(S2-)
B.c(H+)
C.Kw
D.氢硫酸电离平衡常数
E.氢硫酸的电离度
填空题 (本题共11分)本题有2小题。在一体积为2L的密闭容器中,气态物质A、B、E的物质的量n随时间t的变化如图所示。已知达到平衡后,降低温度A的转化率增大。

29、写出此反应的化学方程式_________________________________;此反应是___________热反应。
30、根据图数据,从反应开始到第一次达到平衡时平均速率v (E)为________________。
31、在5~7 min内曲线变化的原因可能是____(填编号)
A. 降低了温度 B. 使用了催化剂
C. 减小了容器的体积 D. 减少了A的物质的量
32、设该反应达到平衡时的平衡常数为K1,保持温度不变,将容器体积减少一半,达到新的平衡后,测得B的平衡浓度为原来的2.2倍,平衡常数为K2,则_______(填编号)
A. 平衡向正反应方向移动,且K2 > K1
B. 平衡移动过程中,正反应速率大于逆反应速率
C. 达到新平衡时,A的浓度增大,且K1 > K2
D. 达到新平衡时,E的浓度是原来的2倍多,且K1 = K2
已知在25℃时,亚硝酸、次氯酸和氢硫酸的电离常数分别为:
亚硝酸 Ki = 4.6×10-4
次氯酸 Ki = 3.0×10-8
氢硫酸 Ki 1= 9.1×10-8 Ki 2 = 1.1×10-12
33、写出氢硫酸的第一级电离平衡常数表达式:Ki1 = _________________。
34、在相同条件下,试比较H2S、HS-、HClO和HNO2的酸性强弱:______>______>_____>_______。
35、保持温度不变,在氢硫酸溶液中加入少量盐酸,下列量会变小的是_____(填序号)
A.c(S2-)
B.c(H+)
C.Kw
D.氢硫酸电离平衡常数
E.氢硫酸的电离度
本题答案:29、 2A + Emakesmallpic(this,600,1800);' src=) 2B;达到平衡后,降低温度A的转化率增大,这说明降低温度平衡向逆反应方向进行,所以正方应是放热反应。
2B;达到平衡后,降低温度A的转化率增大,这说明降低温度平衡向逆反应方向进行,所以正方应是放热反应。
30、从反应开始到第一次达到平衡时E的浓度减少了0.3mol÷2L=0.15mol/L,则反应速率v (E)=0.15mol/L÷3min=0.05mol/(L·min).。
31、根据图像可知在5~7 min内A、E物质的量逐渐减小,而B的物质的量逐渐增大,这说明平衡向正反应方向进行。由于正方应是体积减小的放热的可逆反应,因此曲线变化的原因可能是降低了温度,答案选A。
32、若假设该反应达到平衡时的平衡常数为K1,保持温度不变,将容器体积减少一半,压强增大,正逆反应速率均增大,平衡向正反应方向进行。A、平衡向正反应方向移动,温度不变,则K2=K1,A错误;B、平衡移动过程中,正反应速率大于逆反应速率,B正确;C、达到新平衡时,根据勒夏特列原理可知,A的浓度比原平衡时增大,但平衡常数不变,C错误;D、体积减小的瞬间,E的浓度是原来的2倍。平衡向正反应方向进行,因此达到新平衡时,E的浓度比原来的2倍小,且K1 = K2,D错误,答案选B。
33、平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据氢硫酸的电离平衡方程式可知,氢硫酸的第一级电离平衡常数表达式:Ki1 = 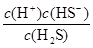 。
。
34、在相同条件下,电离平衡常数越大,酸性越强,则根据平衡常数可知H2S、HS-、HClO和HNO2的酸性强弱为:HNO2>H2S>HClO>HS-。
35、保持温度不变,在氢硫酸溶液中加入少量盐酸,氢离子浓度增大,抑制氢硫酸的电离。则A、c(S2-)减小,A正确;B、加入盐酸,c(H+)增大,B错误;C、Kw只与温度有关系,温度不变,水的离子积常数不变,C错误;D、氢硫酸电离平衡常数也只与温度有关系,温度不变,平衡常数不变,D错误;E、抑制电离,则氢硫酸的电离度减小,E正确,答案选AE。
考点:考查反应速率、平衡常数的有关判断与计算;外界条件对平衡状态的影响以及电离平衡常数的应用
本题所属考点:【化学平衡】
本题难易程度:【困难】
Everybody's business is nobody's business. 人人负责,无人负责. /龙多四靠.