|
|
|
(14分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。<b【化学平衡】
2016-12-26 17:20:23
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (14分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH= -196.6kJ·mol-1 2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH= -113.0kJ·mol-1 2NO2(g) ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。 SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
| A.体系压强保持不变 | B.混合气体颜色保持不变
| | C.SO3和NO的体积比保持不变 | D.每消耗1molSO3的同时生成1mol NO
| 测得上述反应达平衡时NO2与SO2的体积比为5∶1,则平衡常数K= 。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
1.3×104kPa左右,选择此压强的理由是: 。
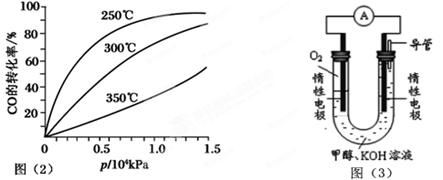
(3)依据燃烧的反应原理,合成的甲醇可以设计 如图(3)所示的原电池装置。
①该电池工作时,OH-向 极移动(填“正”或“负”)。
②该电池正极的电极反应式为 。
填空题 (14分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH= -196.6kJ·mol-1 2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH= -113.0kJ·mol-1 2NO2(g) ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。 SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
| A.体系压强保持不变 | B.混合气体颜色保持不变
|
| C.SO3和NO的体积比保持不变 | D.每消耗1molSO3的同时生成1mol NO
|
测得上述反应达平衡时NO2与SO2的体积比为5∶1,则平衡常数K=
。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)

CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
1.3×104kPa左右,选择此压强的理由是:
&# 160; 。

(3)依据燃烧的反应原理,合成的甲醇可以设计如图(3)所示的原电池装置。
①该电池工作时,OH-向
极移动(填“正”或“负”)。
②该电池正极的电极反应式为
。
本题答案:(1)-41.8 BD&
本题解析:
试题分析:(1)根据盖斯定律,②-①即得出2NO2(g)+2SO2(g)

2SO3(g)+2NO(g) ΔH=ΔH2-ΔH1="-113.0" kJ·mol-1+196.6 kJ·mol-1=+83.6kJ·mol-1,所以答案是41.8 kJ·mol-1;反应NO2(g)+SO2(g)

SO3(g)+NO(g)的特点体积不变的、吸热的可逆反应,对于体积不变的反应压强不能说明达到平衡状态,A错误,颜色的深浅与气体的浓度大小有关,而在反应体系中只有二氧化氮是红棕色气体,所以混合气体颜色保持不变时即说明NO2的浓度不再发生变化,因此B正确;SO3和NO是生成物,因此在任何情况下二者的体积比总是满足1:1,C错误;SO3和NO2一个作为生成物,一个作为反应物,因此每消耗1 mol SO3的同时生成1 molNO,可以说明该反应达到平衡状态;设加入的二氧化硫物质的量为a,则二氧化氮的为2a,
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的量 2a a 0 0
转化物质的量 x x x x
平衡物质的量 2a-x a-x x x
则(2a-x):(a-x)=5:1,x=3a/4,则平衡时,C( NO2)=5a/4Vmol/L,C(SO2)=a/4Vmol/L
C(SO3)=C(NO)=3a/4V,平衡常数K="(3a/4×3a/4)/(" 5a/4V×a/4V)=1.8。
(2)由图可知,温度升高,CO的转化率降低,平衡向逆反应方向移动,故逆反应是吸热反应,正反应是放热反应,△H<0;压强大,有利于加快反应速率,有利于使平衡正向移动,但压强过大,需要的动力大,对设备的要求也高,故选择250℃、1.3×104kPa左右的条件.因为在250℃、压强为1.3×104kPa时,CO的转化率已较大,再增大压强,CO的转化率变化不大,没有必要再增大压强。
(3)依据甲醇燃烧的反应原理,结合如图所示的原电池装置,负极上失电子发生氧化反应,正极上得到电子发生还原反应;一般燃料在负极上发生反应,氧气在正极发生还原反应;负极电极反应为:CH3OH+8OH--6e-=CO32-+6H2O;阴离子移向负极;正极电极反应为:O2+2H2O+4e-=4OH-;故答案为:负;O2+2H2O+4e-=4OH-。
考点:考查盖斯定律、化学平衡应用、原电池。
本题所属考点:【化学平衡】
本题难易程度:【困难】
Don't trouble trouble till trouble troubles you. 麻烦没有来找你,不要去找麻烦。
 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
 2SO3(g)+2NO(g) ΔH=ΔH2-ΔH1="-113.0" kJ·mol-1+196.6 kJ·mol-1=+83.6kJ·mol-1,所以答案是41.8 kJ·mol-1;反应NO2(g)+SO2(g)
2SO3(g)+2NO(g) ΔH=ΔH2-ΔH1="-113.0" kJ·mol-1+196.6 kJ·mol-1=+83.6kJ·mol-1,所以答案是41.8 kJ·mol-1;反应NO2(g)+SO2(g) SO3(g)+NO(g)的特点体积不变的、吸热的可逆反应,对于体积不变的反应压强不能说明达到平衡状态,A错误,颜色的深浅与气体的浓度大小有关,而在反应体系中只有二氧化氮是红棕色气体,所以混合气体颜色保持不变时即说明NO2的浓度不再发生变化,因此B正确;SO3和NO是生成物,因此在任何情况下二者的体积比总是满足1:1,C错误;SO3和NO2一个作为生成物,一个作为反应物,因此每消耗1 mol SO3的同时生成1 molNO,可以说明该反应达到平衡状态;设加入的二氧化硫物质的量为a,则二氧化氮的为2a,
SO3(g)+NO(g)的特点体积不变的、吸热的可逆反应,对于体积不变的反应压强不能说明达到平衡状态,A错误,颜色的深浅与气体的浓度大小有关,而在反应体系中只有二氧化氮是红棕色气体,所以混合气体颜色保持不变时即说明NO2的浓度不再发生变化,因此B正确;SO3和NO是生成物,因此在任何情况下二者的体积比总是满足1:1,C错误;SO3和NO2一个作为生成物,一个作为反应物,因此每消耗1 mol SO3的同时生成1 molNO,可以说明该反应达到平衡状态;设加入的二氧化硫物质的量为a,则二氧化氮的为2a,