微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (12分)氮元素可以形成多种氢化物,如NH3、N2H4等。
(1)据报道,2016年中国将发射“天宫二号”空间实验室,并发射“神舟十一号”载人飞船和“天舟一号”货运飞船,与“天宫二号”交会对接。火箭升空需要高能燃料,通常用肼(N2H4)作燃料,N2O4作氧化剂。已知
N2(g)+O2(g)=2NO(g)△H=+180.7kJ?mol-1
2NO(g)+O2(g)=2NO2(g)△H=-113.0kJ?mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
2NO2(g) N2O4(g)△H=-52.7kJ?mol-1
N2O4(g)△H=-52.7kJ?mol-1
写出气态肼在气态四氧化二氮中燃烧生成氨气和气态水的热化学方程式:______________.
(2)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如下所示:
CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如下所示:
T/℃
| 165
| 175
| 185
| 195
|
K
| 111.9
| 74.1
| 50.6
| 34.8
|
①该反应的△H 0(填“>”或“<”)。
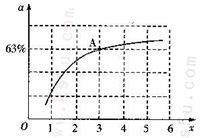
②已知原料气中的氨碳比 为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如下图所示。a随着x的增大而增大的原因是__________。图中A点处, NH3的平衡转化率为__________。
为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如下图所示。a随着x的增大而增大的原因是__________。图中A点处, NH3的平衡转化率为__________。
(3)①在氢水加水稀释的过程中,NH3·H2O的电离程度____(填“增大”、“减小”或“不变”,下同), 的值__________。
的值__________。
②室温下,amol/L的(NH4)2SO4溶液的pH=5,原因是__________________(用离子方程式表示),该反应的平衡常数为__________(用含a的数学表达式表示)。
填空题 (12分)氮元素可以形成多种氢化物,如NH3、N2H4等。
(1)据报道,2016年中国将发射“天宫二号”空间实验室,并发射“神舟十一号”载人飞船和“天舟一号”货运飞船,与“天宫二号”交会对接。火箭升空需要高能燃料,通常用肼(N2H4)作燃料,N2O4作氧化剂。已知
N2(g)+O2(g)=2NO(g)△H=+180.7kJ?mol-1
2NO(g)+O2(g)=2NO2(g)△H=-113.0kJ?mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
2NO2(g) N2O4(g)△H=-52.7kJ?mol-1
N2O4(g)△H=-52.7kJ?mol-1
写出气态肼在气态四氧化二氮中燃烧生成氨气和气态水的热化学方程式:______________.
(2)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如下所示:
CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如下所示:
T/℃
| 165
| 175
| 185
| 195
|
K
| 111.9
| 74.1
| 50.6
| 34.8
|
①该反应的△H 0(填“>”或“<”)。
②已知原料气中的氨碳比 为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如下图所示。a随着x的增大而增大的原因是__________。图中A点处,NH3的平衡转化率为__________。
为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如下图所示。a随着x的增大而增大的原因是__________。图中A点处,NH3的平衡转化率为__________。

(3)①在氢水加水稀释的过程中,NH3·H2O的电离程度____(填“增大”、“减小”或“不变”,下同), 的值__________。
的值__________。
②室温下,amol/L的(NH4)2SO4溶液的pH=5,原因是__________________(用离子方程式表示),该反应的平衡常数为__________(用含a的数学表达式表示)。
本题答案:(1)2N2H4(g)+N2O4(g)由①N2(g)+O2(g)=2NO(g)△H=+180.7kJ?mol-1<br>②2NO(g)+O2(g)=2NO2(g)△H=-113.0kJ?mol-1<br>③N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1<br>④2NO2(g)<img onload='if(this.width>600)makesmallpic(this,600,1800);' src=) N2O4(g)△H=-52.7kJ?mol-1
N2O4(g)△H=-52.7kJ?mol-1
根据盖斯定律可知?×2-④-?-?得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),
△H=(-534.0kJ?mol-1)×2-(-52.7kJ?mol- 1)-(180.7kJ?mol-1)-(-113.0kJ?mol-1)=-1083.0 kJ?mol-1,
即热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083.0 kJ?mol-1;(2)①随着温度升高,K值减小,正反应方向为放热,ΔH<0;②根据题给图象分析,增大氨气浓度平衡正向进行,从而提高二氧化碳的转化率;A点处x=3,原料气中的NH3和CO2的物质的量之比为3,二氧化碳转化率为63%,假设氨气为3mol,二氧化碳为1mol,则反应的二氧化碳为0.63mol,依据化学方程式
2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l)反应的氨气为1.26mol,NH3的平衡转化率="1.26mol÷3mol×100%=42%" ;(3)①在氨水加水稀释的过程中,氨水的电离程度增大,电离平衡常数K值只与温度有关,不变;②室温下,amol/L的(NH4)2SO4溶液的pH=5,原因是铵根发生了水解:NH+H2O
CO(NH2)2(l)+H2O(l)反应的氨气为1.26mol,NH3的平衡转化率="1.26mol÷3mol×100%=42%" ;(3)①在氨水加水稀释的过程中,氨水的电离程度增大,电离平衡常数K值只与温度有关,不变;②室温下,amol/L的(NH4)2SO4溶液的pH=5,原因是铵根发生了水解:NH+H2O NH3·H2O+H+;该反应的平衡常数为K=C(NH3·H2O)·C(H+)/C(NH4+)=
NH3·H2O+H+;该反应的平衡常数为K=C(NH3·H2O)·C(H+)/C(NH4+)=
考点:考查盖斯定律、热方程式的书写,化学平衡常数及化学平衡的图像和计算,弱电解质的电离和盐类的水解。
本题所属考点:【化学平衡】
本题难易程度:【困难】
Conceited [=ingenious] goods are quickly spent. 花哨货,不经用.