微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
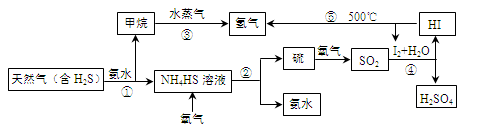
填空题 (15分)开发氢能是实现社会可持续发展的需要。下图是以含H2S杂质的天然气为原料制取氢气的流程图。
回答下列问题:
(1)反应②的化学方程式为 。
(2)反应④的离子方程式为 。
(3)步骤③中制氢气的原理如下:
Ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
Ⅱ:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
①对于反应Ⅰ,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 (填字母代号)。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应Ⅱ,将CO进一步转化,可提高H2的产量。若1.00 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.1 8 mol CO、CO2和H2的混合气体,则CO的转化率为 。
③若该天然气中硫化氢的体积分数为5%,且甲烷与水蒸气反应转化成二氧化碳和氢气的总转化率为80%,则通过上述流程1.00 m3天然气理论上可制得氢气 m3(同温同压条件下)。
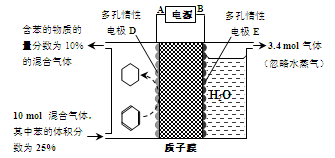
(4)一定条件下,如图所示装置可实现有机物的电化学储氢(生成的有机物为气体,忽略其他有机物)。
①生成目标产物的电极反应式为 。
②该储氢装置的电流效率为η= 。(η=  ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
填空题 (15分)开发氢能是实现社会可持续发展的需要。下图是以含H2S杂质的天然气为原料制取氢气的流程图。

回答下列问题:
(1)反应②的化学方程式为 。
(2)反应④的离子方程式为 。
(3)步骤③中制氢气的原理如下:
Ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
Ⅱ:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
①对于反应Ⅰ,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 (填字母代号)。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应Ⅱ,将CO进一步转化,可提高H2的产量。若1.00 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为 。
③若该天然气中硫化氢的体积分数为5%,且甲烷与水蒸气反应转化成二氧化碳和氢气的总转化率为80%,则通过上述流程1.00 m3天然气理论上可制得氢气 m3(同温同压条件下)。
(4)一定条件下,如图所示装置可实现有机物的电化学储氢(生成的有机物为气体,忽略其他有机物)。
①生成目标产物的电极反应式为 。
②该储氢装置的电流效率为η= 。(η=  ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)

本题答案:(1)2NH4HS+O2=2NH3·H2O+2S↓
本题解析:
试题分析:(1)氧气具有氧化性,能氧化硫离子生成单质S,则根据流程图可知反应②的化学方程式为2NH4HS+O2=2NH3·H2O+2S↓。
(2)碘水具有氧化性,能氧化SO2生成硫酸,则反应④的离子方程式为SO2+I2+2H2O=4H++SO42-+2I-。
(3)①正方应是体积增大的吸热反应,则a.升高温度反应速率增大,平衡向正反应方向进行,有利于生成氢气,正确;b.增大水蒸气浓度,反应速率增大平衡向正反应方向移动,但氢气含量不一定增大,错误;c.加入催化剂加快反应速率但平衡不移动,氢气含量不变,错误;d.降低压强,反应速率降低,错误,答案选a。
②1.00 mol CO和H2的混合气体(CO的体积分数为20%)中CO和氢气的物质的量分别是0.2mol和0.8mol。设与H2O反应时消耗CO的物质的量是xmol,则根 据方程式可知生成CO2和氢气的物质的量分别是都是xmol,由于后得到1.18 mol CO、CO2和H2的混合气体,则0.2-x+x+0.8+x=1.18,解得x=0.18,所以CO的转化率为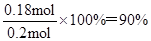 。
。
③若该天然气中硫化氢的体积分数为5%,且甲烷与水蒸气反应转化成二氧化碳和氢气的总转化率为80%,;H2S的体积是0.05m3,甲烷是0.95m3。0.05m3H2S最终可以得到氢气0.05m3。根据反应I可知生成氢气的体积是0.95m3×80%×3=2.28m3,CO的体积是0.95m3×80%=0.76m3,则通过反应Ⅱ又生成氢气0.76m3,所以通过上述流程1.00 m3天然气理论上可制得氢气0.05m3+2.28m3+0.76m3=3.09m3。
(4)①根据题意可知该实验的目的是电化学储氢,所以阴极上发生的反应为生产目标产物,即阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12;
②电解池中阳极上氢氧根离子放电生成氧气,根据装置图可知阳极上生成3.4mol氧气转移电子的物质的量=3.4mol×4=13.6mol;根据水的组成可知生成1mol氧气时生成2mol氢气,则生成3.4mol氧气时同时生成6.8mol氢气。设参加反应的苯的物质的量是xmol,则参加反应的氢气的物质的量是3xmol,剩余苯的物质的量为10mol×25%-xmol,而反应后苯的含量=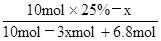 ×100%=10%,解得x=
×100%=10%,解得x= 。所以苯转化为环己烷转移电子的物质的量为
。所以苯转化为环己烷转移电子的物质的量为 ×6,则该储氢装置的电流效率为η=
×6,则该储氢装置的电流效率为η=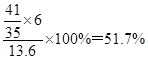 。
。
考点:考查物质制备工艺流程图的分析与应用
本题所属考点:【化学平衡】
本题难易程度:【困难】
A friend's frown is better than a fool's smile. 朋友对你皱眉,胜过傻瓜对你微笑.