微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (本题共12分)氨是一种重要的化工产品。“一氧化碳变换”是合成氨原料气生产中的重要环节,其反应方程式为:CO(g) + H2O(g) CO2(g) + H2(g)
CO2(g) + H2(g)
完成下列填空:
23.恒温恒容条件下,能说明该反应达到平衡状态的是 (填字母序号)。
a.ν(CO)消耗= ν(H2O)生成 b.c(CO2) = c(CO)
c.混合气体的总压不再改变 d.混合气体的密度不再改变
24.将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验组
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
|
| CO
| H2O
| CO2
| CO
|
1
| 650
| 4
| 2
| 1.6
| 2.4
| 5
|
2
| 900
| 2
| 1
| 0.4
| 1.6
| 3
|
3
| 650
| 2
| 1
| A
| B
| t
|
①实验1中从反应开始到达到平衡,以H2的浓度变化表示的反应速率为 。
②A = 。
③平衡常数:K(900℃) K(650℃) (填“>”、“<”或“=”=)。
25.温度是一氧化碳变换中最重要的工艺条件,实际生产过程中将温度控制在400℃左右,可能的原因是 。
26.C、H、O、N元素中,核外电子占据5个不同轨道的原子,其最外层电子排布式是 。这四种元素形成的化合物 (填“一定是”、“一定不是”、“不一定是”)离子化合物。
27.能证明碳的非金属性比硅强的事实是 (选填编号)。
a.酸性:H2CO3强于H2SiO3 b.高温下SiO2与C生成Si和CO
c.键的极性:C-H > Si-H d.熔点:金刚石 > 单晶硅
填空题 (本题共12分)氨是一种重要的化工产品。“一氧化碳变换”是合成氨原料气生产中的重要环节,其反应方程式为:CO(g) + H2O(g) CO2(g) + H2(g)
CO2(g) + H2(g)
完成下列填空:
23.恒温恒容条件下,能说明该反应达到平衡状态的是 (填字母序号)。
a.ν(CO)消耗= ν(H2O)生成 b.c(CO2) = c(CO)
c.混合气体的总压不再改变 d.混合气体的密度不再改变
24.将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验组
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
|
| CO
| H2O
| CO2
| CO
|
1
| 650
| 4
| 2
| 1.6
| 2.4
| 5
|
2
| 900
| 2
| 1
| 0.4
| 1.6
| 3
|
3
| 650
| 2
| 1
| A
| B
| t
|
①实验1中从反应开始到达到平衡,以H2的浓度变化表示的反应速率为 。
②A = 。
③平衡常数:K(900℃) K(650℃) (填“>”、“<”或“=”=)。
25.温度是一氧化碳变换中最重要的工艺条件,实际生产过程中将温度控制在400℃左右,可能的原因是 。
26.C、H、O、N元素中,核外电子占据5个不同轨道的原子,其最外层电子排布式是 。这四种元素形成的化合物 (填“一定是”、“一定不是”、“不一定是”)离子化合物。
27.能证明碳的非金属性比硅强的事实是 (选填编号)。
a.酸性:H2CO3强于H2SiO3 b.高温下SiO2与C生成Si和CO
c.键的极性:C-H > Si-H d.熔点:金刚石 > 单晶硅
本题答案:23、 a(2分) 24、 ①0.16mol/(L.min)
本题解析:
试题分析:23、在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a.ν(CO)消耗= ν(H2O)生成表示正逆反应速率相等,a正确;b.c(CO2) = c(CO)并不能表示二者的浓度不再发生变化,因此不一定说明反应达到平衡状态,b错误;c.反应前后体积不变,因此压强始终不变,则混合气体的总压不再改变不能说明反应达到平衡状态,c错误;d.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此混合气体的密度不再改变不能说明反应达到平衡状态,d错误,答案选a。
24、①根据表中数据可知实验1中从反应开始到达到平衡时生成CO21.6mol,则根据方程式可知生成氢气也是1.6mol,氢气浓度是0.8mol/L,所以以H2的浓度变化表示的反应速率为0.8mol/L÷5min=0.16mol/(L.min)。
②根据实验1中数据可知平衡时CO、水蒸气、CO2和氢气的平衡浓度分别是1.2mol/L、0.2mol/L、0.8mol/L、0.8mol/L,所以该温度下平衡常数K=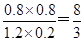 。设实验3中A=x,则平衡时CO、水蒸气、CO2和氢气的平衡浓度分别是(1-0.5x)mol/L、(0.5-0.5x)mol/L、0.5xmol/L、0.5xmol/L,所以
。设实验3中A=x,则平衡时CO、水蒸气、CO2和氢气的平衡浓度分别是(1-0.5x)mol/L、(0.5-0.5x)mol/L、0.5xmol/L、0.5xmol/L,所以 ,解得x=0.8。
,解得x=0.8。
③根据实验2中数据可知平衡时CO2的物质的量是0.4mol,与实验3相比这说明升高温度CO2的物质的量减小,即升高温度平衡向逆反应方向进行,所以900℃时的平衡常数小于650℃时平衡常数。
25、由于该反应需要使用催化剂,此温度是催化剂的活性温度;另外生成CO的反应是吸热反应,升高温度有利于提高CO的转化率,所以实际生产过程中将温度控制在400℃左右。
26、C、H、O、N元素中,核外电子占据5个不同轨道的原子是N和O,根据核外 电子排布规律可知其最外层电子排布式分别是2s22p3、 2s22p4。这四种元素形成的化合物不一定是离子化合物,例如尿素(NH2)2CO等。
27、a.非金属性越强,最高价氧化物水化物的酸性越强,则酸性H2CO3强于H2SiO3可以说明碳的非金属性比硅强,a正确;b.高温下SiO2与C生成Si和CO属于难挥发性物质制备易挥发性,与非金属性强弱无关系,b错误;c.非金属性越强,与H盐酸形成的共价键极性越强,则键的极性C-H > Si-H可以说明碳的非金属性比硅强,,c正确;d.非金属性强弱与其单质的熔点高低无关系,d错误,答案选ac。
考点:考查平衡状态判断、计算、外界条件对平衡状态的影响、核外电子排布以及非金属性强弱比较
本题所属考点:【化学平衡】
本题难易程度:【困难】
Half a tale is enough for a wise man. 智者一说就领会. /响鼓不用重棰敲.