微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (15分)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:
CO2 (g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质
| CH4
| CO2
| CO
| H2
|
体积分数
| 0.1
| 0.1
| 0.4
| 0.4
|
①此温度下该反应的平衡常数K=__________
②已知: 《1》CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=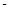 890.3 kJ·mol-1
890.3 kJ·mol-1
《2》CO(g)+H2O (g)=CO2(g)+H2 (g) △H=+2.8 kJ·mol-1
《3》2CO(g)+O2(g)=2CO2(g) △H=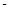 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=________________
2CO(g)+2H2(g) 的△H=________________
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
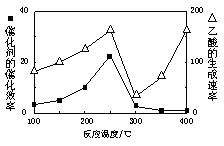
①在不同温度下催化剂的催化效 率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
②为了提高该反应中CH4的转化率,可以采取的措施是 。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为 。
(3)①Li2O、Na2O、MgO均能吸收CO2。①如果寻找吸收CO2的其他物质,下列建议合理的是_____。
A.可在碱性氧化物中寻找
B.可在ⅠA、ⅡA族元素形成的氧化物中寻找
C.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是 。
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O CO+H2+O2
CO+H2+O2
高温电解技术能高效实现(3)中反应A,工作原理示意图如下:
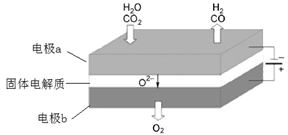
CO2在电极a放电的反应式是__________________________________________。
填空题 (15分)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:
CO2 (g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质
| CH4
| CO2
| CO
| H2
|
体积分数
| 0.1
| 0.1
| 0.4
| 0.4
|
①此温度下该反应的平衡常数K=__________
②已知: 《1》CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=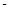 890.3 kJ·mol-1
890.3 kJ·mol-1
《2》CO(g)+H2O (g)=CO2(g)+H2 (g) △H=+2.8 kJ·mol-1
《3》2CO(g)+O2(g)=2CO2(g) △H=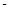 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=________________
2CO(g)+2H2(g) 的△H=________________
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。

②为了提高该反应中CH4的转化率,可以采取的措施是 。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为 。
(3)①Li2O、N 91Exam.orga2O、MgO均能吸收CO2。①如果寻找吸收CO2的其他物质,下列建议合理的是_____。
A.可在碱性氧化物中寻找
B.可在ⅠA、ⅡA族元素形成的氧化物中寻找
C.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是 。
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O CO+H2+O2
CO+H2+O2
高温电解技术能高效实现(3)中反应A,工作原理示意图如下:

CO2在电极a放电的反应式是__________________________________________。
本题答案:(1)① 64(2分) &
本题解析:
试题分析:(1)①假设在反应过程是CO2改变的物质的量是x,则平衡时各种气体的物质的量是CO2:(6-x)mol;CH4:(6-x)mol ;CO:2xmol;H2:2xmol。根据题意可得:(6-x)mol ÷[(6-x)mol+(6-x)mol+2xmol+2xmol]=0.1,解得x=4。因此平衡混合体系中物质的浓度分别是:c(CO2)=c(CH4)=0.5mol/L;c(CO)=c(H2)=2mol/L,因此化学平衡常数K=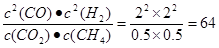 ;②《1》+《2》×2—《3》×2,整理可得CO2(g)+CH4(g)
;②《1》+《2》×2—《3》×2,整理可得CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=+247.3 kJ/mol;(2)①在250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低;②由于正反应是气体体积减小的反应,所以为了提高该反应中CH4的转化率,可以采取的措施是增大压强或增大CO2的浓度;(3)①由于Li2O、Na2O、MgO均能吸收CO2,Li、Na是碱金属元素,位于第
2CO(g)+2H2(g) 的△H=+247.3 kJ/mol;(2)①在250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低;②由于正反应是气体体积减小的反应,所以为了提高该反应中CH4的转化率,可以采取的措施是增大压强或增大CO2的浓度;(3)①由于Li2O、Na2O、MgO均能吸收CO2,Li、Na是碱金属元素,位于第 ;Mg是碱土金属,在元素周期表中位于第
;Mg是碱土金属,在元素周期表中位于第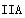 族,所以所以如果寻找吸收CO2的其他物质,可在碱性氧化物中寻找或可在ⅠA、ⅡA族元素形成的氧化物中寻找,选项是A、B;②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是CO2 + Li4SiO4
族,所以所以如果寻找吸收CO2的其他物质,可在碱性氧化物中寻找或可在ⅠA、ⅡA族元素形成的氧化物中寻找,选项是A、B;②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是CO2 + Li4SiO4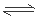 Li2CO3 + Li2SiO3;(4)CO2在阴极得到电子变为CO,所以a电解是阴极,与电源的负极连接,在电极a放电的反应式是CO2 + 2e- =CO+O2-。
Li2CO3 + Li2SiO3;(4)CO2在阴极得到电子变为CO,所以a电解是阴极,与电源的负极连接,在电极a放电的反应式是CO2 + 2e- =CO+O2-。
考点:考查提高物质平衡转化率的措施、化学平衡常数的计算、化学方程式和反应的热化学方程式的书写、气体吸收试剂的选择标准、电解原理的应用的知识。
本题所属考点:【化学平衡】
本题难易程度:【困难】
He is wise that knows when he is well enough. 知足为智者。