微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (本题14分)
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)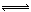 2NH3(g)+Q(Q>0)
2NH3(g)+Q(Q>0)
一种工业合成氨的简易流程图如下:

完成下列填空:
28.天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生。NH4 HS的电子式是_______________,写出再生反应的化学方程式:_______________。NH3的沸点高于H2S,是因为NH3分子之间存在着一种比_________力更强的作用力。
29.室温下,0.1 mol/L的氯化铵溶液和0.1 mol/L的硫酸氢铵溶液,酸性更强的是_______,其原因是_______。
已知:H2SO4:Ki2=1.2×10-2 NH3·H2O:Ki=1.8×10-5
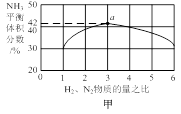
30.图甲表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:______(答案用小数表示,保留3位有效数字)。
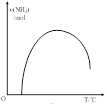
31.依据温度对合成氨反应的影响,在图乙坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。

32.上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。
简述本流程中提高合成氨原料总转化率的方法:________________________________。
填空题 (本题14分)
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)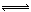 2NH3(g)+Q(Q>0)
2NH3(g)+Q(Q>0)
一种工业合成氨的简易流程图如下:

完成下列填空:
28.天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生。NH4HS的电子式是_______________,写出再生反应的化学方程式:_______________。NH3的沸点高于H2S,是因为NH3分子之间存在着一种比_________力更强的作用力。
29.室温下,0.1 mol/L的氯化铵溶液和0.1 mol/L的硫酸氢铵溶液,酸性更强的是_______,其原因是_______。
已知:H2SO4:Ki2=1.2×10-2 NH3·H2O:Ki=1.8×10-5
30.图甲表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:______(答案用小数表示,保留3位有效数字)。
31.依据温度对合成氨反应的影响,在图乙坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。


32.上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。
简述本流程中提高合成氨原料总转化率的方法:________________________________。
本题答案:(共14分)28.makesmallpic(this,600,1800);' src=) ;根据题意再生反应的化学方程式是2NH4HS+O2=2S↓+2NH3·H2O;NH3的沸点高于H2S,是因为这两种物质都是分子晶体,在NH3分子之间存在着一种比范德华力更强的作用力——氢键。
;根据题意再生反应的化学方程式是2NH4HS+O2=2S↓+2NH3·H2O;NH3的沸点高于H2S,是因为这两种物质都是分子晶体,在NH3分子之间存在着一种比范德华力更强的作用力——氢键。
29.由于在室温下,H2SO4:Ki2=1.2×10-2;NH3·H2O:Ki=1.8×10-5。说明HSO4-的电离作用远大于NH4+的水解作用,HSO4-产生的c(H+)大于铵根离子水解作用产生的c(H+),所以0.1 mol/L的氯化铵溶液和0.1 mol/L的硫酸氢铵溶液,酸性更强的是NH4HSO4。
30.根据图中数据可知: a点时,n(H2):n(N2)=3:1,假如开始时n(N2)=1mol,则n(H2)=3mol,根据方程式:N2(g)+3H2(g)  2NH3(g),在反应过程中消耗N2的物质的量是x,平衡时各种气体的物质的量是n(N2)=(1-x)mol;n(H2)=(3-3x)mol,n(NH3)=2xmol。由于在平衡时NH3的平衡时的体积分数是42%,所以2x÷[(1-x)+ (3-3x)+2x]=" 42%." 解得x=0. 5915mol,所以计算N2的平衡体积分数(1-x) ÷[(1-x)+ (3-3x)+2x]= 0.145。
2NH3(g),在反应过程中消耗N2的物质的量是x,平衡时各种气体的物质的量是n(N2)=(1-x)mol;n(H2)=(3-3x)mol,n(NH3)=2xmol。由于在平衡时NH3的平衡时的体积分数是42%,所以2x÷[(1-x)+ (3-3x)+2x]=" 42%." 解得x=0. 5915mol,所以计算N2的平衡体积分数(1-x) ÷[(1-x)+ (3-3x)+2x]= 0.145。
31.合成氨的反应是放热反应,在反应开始后随着反应的进行,温度逐渐升高没反应速率逐渐加 快,当反应达到平衡时速率达到最大值,安全的含量也达到最大值。此后,随着反应的进行,由于升高温度,平衡向吸热反应的逆反应方向移动,氨气的平衡含量有逐渐减小。故在一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图是
 。
。
32.根据图示可知上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是Ⅳ;在本流程中提高合成氨原料总转化率的方法是对原料气加压,分离液氨后,未反应的N2、H2循环利用。
考点:考查物质电子式、化学方程式的书写、电解质的电离及盐的水解、物质的作用力的种类及强弱比较、物质平衡含量的计算、物质对可逆反应的影响、物质和能量的循环利用的知识。
本题所属考点:【化学平衡】
本题难易程度:【困难】
Every dog has his day. 瓦块也有翻身日,人人都有运来时。