|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (14分)Ⅰ、已知:C(s)+H2O(g) CO(g)+H2(g); ΔH一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表: CO(g)+H2(g); ΔH一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h
| 0
| 1
| 2
| 4
| 8
| 16
| 20
| 25
| 30
| 总压强p/100 kPa
| 4.56
| 5.14
| 5.87
| 6.30
| 7.24
| 8.16
| 8.18
| 8.20
| 8.20
|
回答下列问题:
(1)下列哪些选项可以说明该可逆反应已达平衡状态 。
A.混合气体的密度不再发生改变
B.消耗1 mol H2O(g)的同时生成1 mol H2
C.混合气体的总体积
D.v正(CO) = v逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总= mol;
Ⅱ、根据最新“人工固氮”的报道,在常温、常压、光照条件下,N2在催化剂表面可与水发生反应生成NH3,反应方程式:2N2(g)+ 6H2O(l) 4NH3(g)+ 3O2(g),进一步研究生成量与温度的关系,常压下测得部分数据如下表: 4NH3(g)+ 3O2(g),进一步研究生成量与温度的关系,常压下测得部分数据如下表:

(1)该反应的△H_____O, △S____0(填“>,<,=”)
(2)该反应在30℃、40℃时化学平衡常数分别为K1、K2,则K1_______K2(选填“>,<,=”)
(3)与目前广泛应用的工业合氨相比,该方法的固氮速率慢,氨的生成浓度低,有人提出在常压、450℃下进行该反应,效率将更高,科学家认为该方案不可行,理由是__________.
Ⅲ、向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。
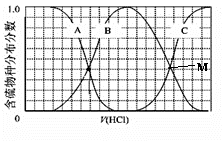
试分析:
①B曲线代表 (用微粒符号表示)分数变化;滴加过程中,溶液中一定成立:c(Na+)= 。
②M点,溶液中主要涉及的离子方程式: 。
填空题 (14分)Ⅰ、已知:C(s)+H2O(g) CO(g)+H2(g); ΔH一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据 见下表: CO(g)+H2(g); ΔH一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据 见下表:
时间t/h
| 0
| 1
| 2
| 4
| 8
| 16
| 20
| 25
| 30
| 总压强p/100 kPa
| 4.56
| 5.14
| 5.87
| 6.30
| 7.24
| 8.16
| 8.18
| 8.20
| 8.20
|
回答下列问题:
(1)下列哪些选项可以说明该可逆反应已达平衡状态 。
A.混合气体的密度不再发生改变
B.消耗1 mol H2O(g)的同时生成1 mol H2
C.混合气体的总体积
D.v正(CO) = v逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总= mol;
Ⅱ、根据最新“人工固氮”的报道,在常温、常压、光照条件下,N2在催化剂表面可与水发生反应生成NH3,反应方程式:2N2(g)+ 6H2O(l) 4NH3(g)+ 3O2(g),进一步研究生成量与温度的关系,常压下测得部分数据如下表: 4NH3(g)+ 3O2(g),进一步研究生成量与温度的关系,常压下测得部分数据如下表:

(1)该反应的△H_____O, △S____0(填“>,<,=”)
(2)该反应在30℃、40℃时化学平衡常数分别为K1、K2,则K1_______K2(选填“>,<,=”)
(3)与目前广泛应用的工业合氨相比,该方法的固氮速率慢,氨的生成浓度低,有人提出在常压、450℃下进行该反应,效率将更高,科学家认为该方案不可行,理由是__________.
Ⅲ、向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。

试分析:
①B曲线代表 (用微粒符号表示)分数变化;滴加过程中,溶液中一定成立:c(Na+)= 。
②M点,溶液中主要涉及的离子方程式: 。
本题答案:I、(1)AD
本题解析:
试题分析:Ⅰ、(1)C(s)+H2O(g) CO(g)+H2(g)在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应过程中气体总质量不断增大,故密度不断增大,当混合气体密度不再发生改变,则反应达到平衡状态,A项正确;反应过程中消耗1 mol H2O(g)的同时生成1 mol H2,B项错误;恒容,故混和气体总体积不变,C项错误;v正(CO) = v逆(H2)则说明正逆反应速率相等,反应达到平衡状态,故D项正确;(2)同温、同体积压强之比等于物质的量之比,故n(总)= P/P0×1mol= P/P0mol;Ⅱ、(1)2N2(g)+ 6H2O(l) CO(g)+H2(g)在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应过程中气体总质量不断增大,故密度不断增大,当混合气体密度不再发生改变,则反应达到平衡状态,A项正确;反应过程中消耗1 mol H2O(g)的同时生成1 mol H2,B项错误;恒容,故混和气体总体积不变,C项错误;v正(CO) = v逆(H2)则说明正逆反应速率相等,反应达到平衡状态,故D项正确;(2)同温、同体积压强之比等于物质的量之比,故n(总)= P/P0×1mol= P/P0mol;Ⅱ、(1)2N2(g)+ 6H2O(l) 4NH3(g)+ 3O2(g),反应,由表中所给NH3的平衡浓度与温度关系可知升高温度NH3的平衡浓度增大,故平衡正向移动,则该反应吸热,△H>0;该反应正向气体量增多,故△S>0;(2)该反应在30℃、40℃时化学平衡常数分别为K1、K2,则K1< K2;(3)在常压、450℃条件下,水处于气态,该反应的△H>0, △S<0,所以该反应不能自发进行,故该反应不可采用常压、450℃;Ⅲ、向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量,发生反应为:①H++ OH—=H2O、②S—+ H+=HS-、③HS-+ H+= H2S,故曲线B代表HS-变化;滴加过程中物料守恒:2c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],或电荷守恒:c(Na+)+ c(H+)= c(Cl-)+c(OH-)+c(HS-)+2c(S2-);M点溶液溶质为:NaCl、NaHS、H2S,故溶液中主要涉及的离子方程式S—+ H+=HS-、HS-+ H+= H2S(或2S2-+3H+=HS-+H2S)。 4NH3(g)+ 3O2(g),反应,由表中所给NH3的平衡浓度与温度关系可知升高温度NH3的平衡浓度增大,故平衡正向移动,则该反应吸热,△H>0;该反应正向气体量增多,故△S>0;(2)该反应在30℃、40℃时化学平衡常数分别为K1、K2,则K1< K2;(3)在常压、450℃条件下,水处于气态,该反应的△H>0, △S<0,所以该反应不能自发进行,故该反应不可采用常压、450℃;Ⅲ、向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量,发生反应为:①H++ OH—=H2O、②S—+ H+=HS-、③HS-+ H+= H2S,故曲线B代表HS-变化;滴加过程中物料守恒:2c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],或电荷守恒:c(Na+)+ c(H+)= c(Cl-)+c(OH-)+c(HS-)+2c(S2-);M点溶液溶质为:NaCl、NaHS、H2S,故溶液中主要涉及的离子方程式S—+ H+=HS-、HS-+ H+= H2S(或2S2-+3H+=HS-+H2S)。
考点:化学反应原理及图像问题。
本题所属考点:【化学平衡】
本题难易程度:【困难】
Time is often said to be mondy,but it is more--it is life. 人们常说时间就是金钱,但不如说----时间就是生命. |