|
|
|
全国各地都遭遇“十面霾伏”。其中,机动车尾气和燃煤产生的烟气【化学平衡】
2016-12-26 17:37:31
来源:91考试网
作者:www.91exam.org 【 大 中 小】
F.平衡后升高温度,平衡常数K增大
填空题 全国各地都遭遇“十面霾伏”。其中,机动车尾气和燃煤产生的烟气对空气质量恶化贡献较大。
Ⅰ.(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) △H<0 2CO2(g)+ N2(g) △H<0
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)

(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。已知:CH4(g)+2NO2(g )=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g) △H=-56.9 kJ/mol N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
Ⅱ.SO2和NOx都是大气污染物。
(3)空气中的NO2可形成硝酸型酸雨,该反应的化学方程式是
(4)利用氨水可以将SO2和NO2吸收,原理如下图所示:

NO2被吸收的离子方程式是 。
(5)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
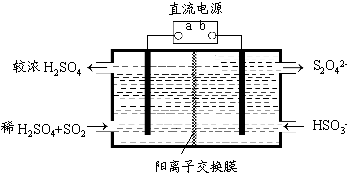
①a为电源的 (填“正极”或“负极”),阳极的电极反应式为 。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为 。
(6)工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g);△H<0,一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,则下列说法正确的是 。 2SO3(g);△H<0,一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,则下列说法正确的是 。
A.若反应速率v(SO2)=v(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
|
E.保持温度和容器体积不变,平衡后再充入2molSO3,再次平衡时各组分浓度均比原平衡时的浓度大
F.平衡后升高温度,平衡常数K增大
本题答案:(1)BD (2)CH4(g)+N2O
本题解析:
试题分析:(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。则A、根据图像可知t1时正反应速率仍然在变化,说明没有达到平衡状态,A错误;B、根据图像可知t1时平衡常数不再变化,正逆反应速率相等,说明达到了平衡状态,B正确;C、根据图像可知t1时二氧化碳和一氧化氮的物质的量还在变化,说明正逆反应速率不相等,反应没有达到平衡状态,C错误;D、根据图像可知t1时一氧化氮的质量分数不再变化,表明正逆反应速率相等,达到了平衡状态,D正确,答案选BD;
(2)已知:CH4(g)+2NO2(g)
本题所属考点:【化学平衡】
本题难易程度:【困难】
Don't teach your grandmother to suck eggs. 不要班门弄斧。