|
|
|
用CO合成甲醇的方程式为:CO(g) + 2H2(g) <img src="http://www.【化学平衡】
2016-12-26 17:38:18
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 用CO合成甲醇的方程式为:CO(g) + 2H2(g)  CH3OH(g) △H<0,按照相同的物质的量投料, 测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 CH3OH(g) △H<0,按照相同的物质的量投料, 测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
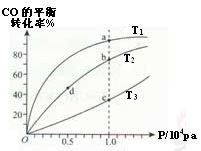
A.温度:T1>T2>T3
B.平衡常数:K(a)>K(c) 、K(b)=K(d)
C.反应速率:υ(a)>υ(c)、υ(b)>υ(d)
D.平均摩尔质量:M(a)<M(c) 、M(b)>M(d)
|
选择题 用CO合成甲醇的方程式为:CO(g) + 2H2(g)  CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是

A.温度:T1>T2>T3
B.平衡常数:K(a)>K(c) 、K(b)=K(d)
C.反应速率:υ(a)>υ(c)、υ(b)>υ(d)
D.平均摩尔质量:M(a)<M(c) 、M(b)>M(d)
|
本题答案:B
本题解析:
试题分析:A、正方应为放热反应,温度越低,CO的转化率越大。根据图像可知T1<T2<T3,A错误;B、根据图像可知图可知,a、c两点压强相同,平衡时a点CO转化率更高。正方应为放热反应,温度越高转化率越小,则温度T1<T3。降低温度平衡向正反应方向移动,因此K(a)>K(c);平衡常数只与温度有关,b、d两点温度相同,平衡常数相同,即K(b)=K(d),B正确;C、根据图像可知图可知,a、c两点压强相同,平衡时a点CO转化率更高。正方应为放热反应,温度越低,CO的转化率越大,故温度T1<T3。温度越高,反应速率越快,则υ(a)<υ(c);b、d两点温度相同,压强越大,反应速率越大,b点大于d点压强,则v(b)>v(d),C错误;D、正方应体积减小,CO转化率的越大,则混合气体的物质的量越小。根据M=m÷n可知,a点气体的物质的量最小,则M(a)>M(c),M(b)>M(d),D错误,答案选B。
考点:考查温度、压强对反应速率和平衡状态的影响
本题所属考点:【化学平衡】
本题难易程度:【一般】
Fall not out with a friend for a trifle. 别为小事与朋友争吵.