微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (14分)
Ⅰ.A、B、C、D、E为五种常见的短周期元素,常温下,A、B可形成B2A2和B2A两种液态化合物,B与D可组成分子X,X水溶液呈碱性,C元素的焰色反应呈黄色,E与C同周期,且E的最高价氧化物的水化物呈两性。试回答:
(1)D元素在周期表中的位置为 ;
(2)由A、D、E三种元素形成的盐的水溶液呈酸性,用离子方程式解释其原因 ;
(3)用A单质和B单质可制取气体燃料电池,该电池用多孔的惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质。写出该电池负极的电极反应式: 。
Ⅱ.将20mLp H=2的NaHSO4溶液逐滴加入到20mL 0.1mol·L-1Na2CO3溶液中,向此反应后的溶液中滴加0.001 mol·L-1BaCl2溶液,首先析出的沉淀是 。[KSP(BaSO4)=1.1×10-10mol2·L-2;KSP(BaCO3)=5.1×10-9mol2·L-2]
Ⅲ.某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g) N(g)+H2(g)
N(g)+H2(g)
n(M):n(H2O)
| M转化率
| H2O转化率
|
1:1
| 0.5
| 0.5
|
1:2
| 0.67
| 0.33
|
1:3
| 0.75
| 0.25
|
①该反应的平衡常数为_____。该温度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正____V逆(填“>”、“<”或“=”)
②结合表中数据判断下列说法中正确的是 。
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85
填空题 (14分)
Ⅰ.A、B、C、D、E为五种常见的短周期元素,常温下,A、B可形成B2A2和B2A两种液态化合物,B与D可组成分子X,X水溶液呈碱性,C元素的焰色反应呈黄色,E与C同周期,且E的最高价氧化物的水化物呈两性。试回答:
(1)D元素在周期表中的位置为 ;
(2)由A、D、E三种元素形成的盐的水溶液呈酸性,用离子方程式解释其原因 ;
(3)用A单质和B单质可制取气体燃料电池,该电池用多孔的惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质。写出该电池负极的电极反应式: 。
Ⅱ.将20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1mol·L-1Na2CO3溶液中,向此反应后的溶液中滴加0.001 mol·L-1BaCl2溶液,首先析出的沉淀是 。[KSP(BaSO4)=1.1×10-10mol2·L-2;KSP(BaCO3)=5.1×10-9mol2·L-2]
Ⅲ.某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g) N(g)+H2(g)
N(g)+H2(g)
n(M):n(H2O)
| M转化率
| H2O转化率
|
1:1
| 0.5
| 0.5
|
1:2
| 0.67
| 0.33
|
1:3
| 0.75
| 0.25
|
①该反应的平衡常数为_____。该温度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正____V逆(填“>”、“<”或“=”)
②结合表中数据判断下列说法中正确的是 。
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85
本题答案:Ⅰ.(1)第二周期、第VA族(2分) (2)Al3++3H2
本题解析:
试题分析:Ⅰ. A、B、C、D、E为五种常见的短周期元素,常温下,A、B可形成B2A2和B2A两种液态化合物,则A是氧元素,B是氢元素。B与D可组成分子X,X水溶液呈碱性,则X是氨气,因此D是氮元素。C元素的焰色反应呈黄色,则C是钠元素。E与C同周期,且E的最高价氧化物的水化物呈两性,所以E是铝。
(1)氮元素的原子序数是7,在周期表中的位置为第二周期、第VA族;
(2)由A、D、E三种元素形成的盐硝酸铝的水溶液中铝离子水解,溶液呈酸性,水解的离子方程式为Al3++3H2O Al(OH)3+3H+。
Al(OH)3+3H+。
(3)原电池中负极失去电子,发生氧化反应,则氢气在负极通入,氧气在正极通入。又因为电解质溶液是浓KOH溶液,则该电池负极的电极反应式H2-2e—+2OH—=2H2O。
Ⅱ.20mLpH=2的NaHSO4溶液的浓度是0.0002mol,20mL 0.1 mol/LNa2CO3的物质的量是0.002mol,如果硫酸氢钠逐滴加入到Na2CO3溶液中,则生成硫酸钠、碳酸氢钠,同时碳酸钠过量。其中溶液中硫酸根的浓度是0.0002mol÷0.04L=0.005mol/L,碳酸根的浓度是(0.002mol—0.0002mol)÷0.04L=0.045mol/L。因此根据溶度积常数可知生成硫酸钡和碳酸钡沉淀时需要钡离子浓度分别是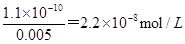 、
、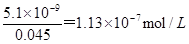 ,所以向此反应后的溶液中滴加0.001 mol·L-1BaCl2溶液,首先析出的沉淀是BaSO4。
,所以向此反应后的溶液中滴加0.001 mol·L-1BaCl2溶液,首先析出的沉淀是BaSO4。
Ⅲ.①由于反应前后气体体积不变,则可以用物质的量代替浓度计算平衡常数。根据表中数据可知n(M):n(H2O)=1:1时,二者的平衡转化率均是50%,所以平衡时四种物质的物质的量相等,则该反应的平衡常数为1。该温度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,则起始时浓度商=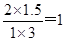 ,因此该反应速率V正=V逆。
,因此该反应速率V正=V逆。
②A.增加H2O(g)的量,平衡向正反应方向进行,则M的转化率升高而H2O(g)的转化率降低,A正确;B.反应物的起始量如果按照化学计量数之比投入,则二者的转化率相等,因此若M与H2O(g)的转化率相同时,二者的初始投入量一定相同,B正确;C.M和H2O(g)初始物质的量之比不一定等于二者转化率之比;D.根据表中数据可知当M与H2O(g)物质的之比为1:4时,M的转化率可能为0.80,D错误,答案选AB。
考点:考查元素推断以及应用、溶度积常数、平衡状态的有关计算等
本题所属考点:【化学平衡】
本题难易程度:【困 难】
False friends are worse than open enemise. 口是心非的朋友比公开的敌人更坏.