微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 工业上消除氮氧化物的污染,可用如下反应:
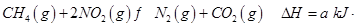 mol-1
mol-1
在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:
温度
| 时间/min
n/mol
| 0
| 10
| 20
| 40
| 50
|
T1
| n(CH4)
| 0.50
| 0.35
| 0.25
| 0.10
| 0.10
|
T2
| n(CH4)
| 0.50
| 0.30
| 0.18
| ……
| 0.15
|
下列说法不正确的是
A.10min内,T1时CH4的化学反应速率比T2时小
B.T1<T2
C.平衡常数:K(T1)<K(T2)
D.a<0
选择题 工业上消除氮氧化物的污染,可用如下反应:
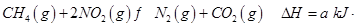 mol-1
mol-1
在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:
温度
| 时间/min
n/mol
| 0
| 10
| 20
| 40
| 50
|
T1
| n(CH4)
| 0.50
| 0.35
| 0.25
| 0.10
| 0.10
|
T2
| n(CH4)
| 0.50
| 0.30
| 0.18
| ……
| 0.15
|
下列说法不正确的是
A.10min内,T1时CH4的化学反应速率比T2时小
B.T1<T2
C.平衡常数:K(T1)<K(T2)
D.a<0
本题答案:C
本题解析:
试题分析:A.根据表中数据可知10min内,T1时CH4的变化量是0.5mol—0.35mol=0.15mol,T2时甲烷的变化量是0.5mol—0.3mol=0.2mol,所以后者的反应速率快,A正确;B.在相同时间内温度为T2时的反应速率快,所以温度是T1<T2,B正确;C来源:91exam .org.温度高平衡时甲烷的物质的量含量高,这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应,则平衡常数:K(T1)>K(T2),C错误;D.根据以上分析可知正方应是放热反应,则a<0,D正确,答案选C。
考点:考查外界条件对反应速率和平衡状态的影响
本题所属考点:【化学平衡】
本题难易程度:【一般】
The overturned cart ahead is a warning to the carts behind. 前车之覆,后车之鉴。