微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (13分)氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应
| 大气固氮
N2 (g)+O2 (g)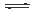 2NO(g) 2NO(g)
| 工业固氮
N2 (g)+3H2 (g) 2NH3(g) 2NH3(g)
|
温度/℃
| 27
| 2000
| 25
| 400
| 450
|
K
| 3.84×10-31
| 0.1
| 5×108
| 0.507
| 0.152
|
①分析数据可知:大气固氮反应属于__________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因__________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较р1、р2的大小关系_________。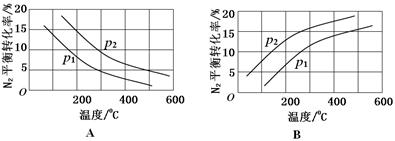
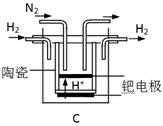
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是_____________。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1) 4NH3(g)+3O2(g),则其反应热ΔH=___________________。
4NH3(g)+3O2(g),则其反应热ΔH=___________________。
(已知:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
2H2(g) +O2(g) 2H2O(l) △H=-571.6kJ·mol-1 )
2H2O(l) △H=-571.6kJ·mol-1 )
填空题 (13分)氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应
| 大气固氮
N2 (g)+O2 (g)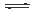 2NO(g) 2NO(g)
| 工业固氮
N2 (g)+ 3H2 (g) 2NH3(g) 2NH3(g)
|
温度/℃
| 27
| 2000
| 25
| 400
| 450
|
K
| 3.84×10-31
| 0.1
| 5×108
| 0.507
| 0.152
|
①分析数据可知:大气固氮反应属于__________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因__________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较р1、р2的大小关系_________。

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是_____________。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1) 4NH3(g)+3O2(g),则其反应热ΔH=___________________。
4NH3(g)+3O2(g),则其反应热ΔH=___________________。
(已知:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
2H2(g) +O2(g) 2H2O(l) △H=-571.6kJ·mol-1 )
2H2O(l) △H=-571.6kJ·mol-1 )
本题答案:(1)①吸热(1分)
②K值小,正向进行的程度小(或转
本题解析:
试题分析:本题以氮的固定为背景考查原理性知识,通过K随温度的变化判断,大气固氮为吸热反应,而且270C时K值太小,化学反应进行的程度小,不适合大规模生产;人工固氮选择5000C左右,因为考虑到催化剂的活性;分析工业固氮的K随温度变化,确定为放热过程,所以A图正确,正反应为气体体积减小的反应,所以压强大N2的转化率高,所以р2>р1;利用电化学反应制取氨气,通入的氮气发生还原反应,且介质为酸性,从而写出电极反应式:N2+6e-+6H+ 2NH3;2N2(g)+6H2O(1)
2NH3;2N2(g)+6H2O(1) 4NH3(g)+3O2(g)可以由反应[(1)×2-(2)×3]得到,根据盖斯定律确定其ΔH=+1530kJ/mol.
4NH3(g)+3O2(g)可以由反应[(1)×2-(2)×3]得到,根据盖斯定律确定其ΔH=+1530kJ/mol.
考点:平衡常数的应用、化学平衡图像、原电池电极反应式的书写、盖斯定律。
本题所属考点:【化学平衡】
本题难易程度:【困难】
He is happy that thinks himself so. 自乐者常乐。