微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (14分)红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
请回答下列问题。
(1)气态 PCl5生成气态PCl3和Cl2的热化学方程式为 。
(2)PC15生成 PCl3和Cl2是一个可逆反应,向5.0L密闭容器中充入0.1 md PCl5(g),反应在不同条件下进行,反应体系总压强随时间的变化关系如图所示。

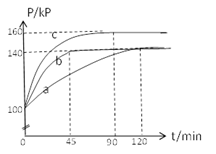
①实验b中PCl5的平衡分解率为 ,其他条件不变,在该实验中再加入 0.1 mol PCl5 (g) ,平衡分解率 (填“增大”、“减小”或“不变”)。
②与实验a相比,c改变的条件是 ,判断依据是 。
(3)PCl5露置于潮湿空气中,能水解生成两种中学化学常见酸,其化学方程式为 。
(4)人的牙齿表面有一层釉质,其组成为羟基磷灰石 Ca5( PO4)3OH(Ksp=6.8×10-37)。为了防止蛀牙,人们常使用含氟离子的牙膏,其中的氟化物可使轻基磷灰石转化为氟磷灰石Ca5( PO4)3F(Ksp=1.0×10-60)。写出该反应的离子方程式 ,该反应的平衡常数为 。
填空题 (14分)红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
请回答下列问题。
(1)气态 PCl5生成气态PCl3和Cl2的热化学方程式为 & #160; 。
(2)PC15生成 PCl3和Cl2是一个可逆反应,向5.0L密闭容器中充入0.1 md PCl5(g),反应在不同条件下进行,反应体系总压强随时间的变化关系如图所示。


①实验b中PCl5的平衡分解率为 ,其他条件不变,在该实验中再加入 0.1 mol PCl5 (g) ,平衡分解率 (填“增大”、“减小”或“不变”)。
②与实验a相比,c改变的条件是 ,判断依据是 。
(3)PCl5露置于潮湿空气中,能水解生成两种中学化学常见酸,其化学方程式为 。
(4)人的牙齿表面有一层釉质,其组成为羟基磷灰石 Ca5( PO4)3OH(Ksp=6.8×10-37)。为了防止蛀牙,人们常使用含氟离子的牙膏,其中的氟化物可使轻基磷灰石转化为氟磷灰石Ca5( PO4)3F(Ksp=1.0×10-60)。写出该反应的离子方程式 ,该反应的平衡常数为 。
本题答案:(14分)(1)PCl5(g) 根据盖斯定律,用上式减去下式后除以2,可得到所求热化学方程式,所以气态 PCl5生成气态PCl3和Cl2的热化学方程式为PCl5(g) 3<img onload='if(this.width>600)makesmallpic(this,600,1800);' src=) PCl3(g) + Cl2(g) △H=+93kJ/mol;
PCl3(g) + Cl2(g) △H=+93kJ/mol;
(2)①开始体系的压强为100kPa,平衡时,为140kPa,压强增大为原来的1.4倍,则气体的物质的量增大到原来的1.4倍,设PCl5的物质的量减少xmol,则生成氯气和三氯化磷的物质的量均是xmol,所以0.1-x+x+x=0.1×1.4,解得x=0.04mol,所以PCl5的分解率为0.04mol/0.1mol×100%=40%;其他条件不变,在该实验中再加人 0.1 mol PCl5 (g),相当于减小容器的体积,压强增大,平衡逆向移动, 则五氯化磷的分解率减小;
②c与a比,平衡时的压强增大,达到平衡的时间变短,说明平衡正向移动,同时反应速率加快,所以改变的条件是升高温度;判断的依据是初始压强没变,反应速率加快且平衡正移程度变大;
(3)根据元素守恒判断五氯化磷水解生成的两种酸为磷酸和HCl,化学方程式是PCl5+4H2O=H3PO4+5HCl;
(4)氟化物可使羟基磷灰石转化为氟磷灰石,因为氟磷灰石比羟基磷灰石更难溶,且该反应是可逆反应,离子方程式是Ca5( PO4)3OH+F- Ca5(PO4)3F+OH-;该反应的平衡常数=6.8×10-37/(1.0×10-60)= 6.8×10-23。
Ca5(PO4)3F+OH-;该反应的平衡常数=6.8×10-37/(1.0×10-60)= 6.8×10-23。
考点:考查盖斯定律的应用,化学平衡的应用,沉淀的转化
本题所属考点:【化学平衡】
本题难易程度:【困难】
Sloth makes all things diffiicult, but industry all things easy. 懒惰使一切都难办;勤奋使凡事皆顺利.