微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (12分)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.5molSO2(g)和0.48molO2(g)放入容积为1L的密闭容器中,反应: 2SO2(g)+O2(g)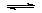 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 & #160; 。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 & #160; 。
(2)若锻烧12gFeS2产生的SO2全部转化为SO3气体时放出19.66kJ热量,产生的SO3与水全部化合生成H2SO4,放出26.06kJ热量,写出SO3气体转化为H2SO4的热化学方程式: 。
(3)将黄铁矿的煅烧产物Fe3O4溶于稀H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其目的是 。
(4)从吸收塔排出的尾气中SO2先用足量氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐,写出有关反应的化学方程式: 、 。
SO2既可作为生产硫酸的原料循环再利用,也可用于海水提溴过程中吸收潮湿空气中的Br2,则SO2吸收Br2的离子方程式是 。
填空题 (12分)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.5molSO2(g)和0.48molO2(g)放入容积为1L的密闭容器中,反应: 2SO2(g)+O2(g)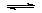 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
(2)若锻烧12gFeS2产生的SO2全部转化为SO3气体时放出19.66kJ热量,产生的SO3与水全部化合生成H2SO4,放出26.06kJ热量,写出SO3气体转化为H2SO4的热化学方程式: 。
(3)将黄铁矿的煅烧产物Fe3O4溶于稀H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其目的是 。
(4)从吸收塔排出的尾气中SO2先用足量氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐,写出有关反应的化学方程式: 、 。
SO2既可作为生产硫酸的原料循环再利用,也可用于海水提溴过程中吸收潮湿空气中的Br2,则SO2吸收Br2的离子方程式是 。
本题答案:(1)96%
本题解析:
试题分析:
(1) 2SO2(g)+O2(g)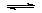 2SO3(g)
2SO3(g)
起始浓度(mol/L) 0.5 0.48 0
转化浓度(mol/L 0.48 0.24 0.48
平衡浓度(mol/L) 0.02 0.24 0.48
由以上所列三段式可知,SO2的平衡转化率为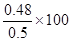 %=96%;
%=96%;
(2)锻烧12gFeS2产生的SO2全部转化为SO3气体时放出19.66kJ热量,依据硫元素守恒,n(S)=2n(FeS2)=
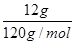 ×2=0.2mol,产生的0.2mol SO3与水全部化合生成H2SO4,放出26.06kJ热量,则1mol SO3与水全部化合生成H2SO4,放出130.3kJ热量,SO3气体转化为H2SO4的热化学方程式为:SO3(g)+ H2O(l)=H2SO4(l) △H=-130.3KJ/mol;
×2=0.2mol,产生的0.2mol SO3与水全部化合生成H2SO4,放出26.06kJ热量,则1mol SO3与水全部化合生成H2SO4,放出130.3kJ热量,SO3气体转化为H2SO4的热化学方程式为:SO3(g)+ H2O(l)=H2SO4(l) △H=-130.3KJ/mol;
(3)Fe3O4溶于稀H2SO4后,生成的Fe2+或Fe3+易水解,要加入稀H2SO4,抑制Fe2+或Fe3+水解;Fe2+易被氧化成Fe3+,故应加入铁粉防止氧化;
(4)从吸收塔排出的尾气中SO2先用足量氨水吸收,再用浓硫酸处理,反应的化学方程式为:SO2+2NH3+H2O=(NH4)2SO3、(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O;
SO2吸收Br2的离子方程式为:SO2+Br2+2H2O=4H++2Br-+SO42-
考点:考查热化学方程式的书写,化学平衡的计算应用,化学方程式离子方程式书写
点评:本题考查了热化学方程式的书写,化学平衡的计算应用,化学方程式和离子方程式书写方法,难度中等。掌握基础是解决本题的关键。
本题所属考点:【化学平衡】
本题难易程度:【困难】
A man without a smiling face must not open a shop. 没有笑脸的人不能开店。