|
|
|
氢气是一种清洁、高效的新型能源。I.用甲烷制取氢气的反应分【影响化学反应速率的因素】
2016-12-26 19:05:01
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 氢气是一种清洁、高效的新型能源。
I.用甲烷制取氢气的反应分为两步,其能量变化如下图所示:
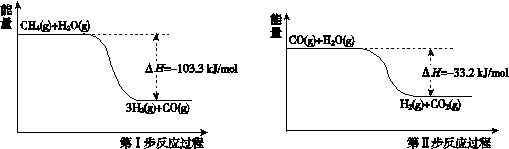
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
II.在容积为1L的密闭容器内,加入0.1molCO和0.1molH2O,在催化剂存在的条件下高温加热使其反应。 测得CO2的浓度随时间变化的图像如图:
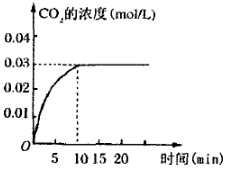
(2)在该温度下,从反应开始至达到平衡时,CO的平均反应速率为 ;
(3)该温度下,此反应的化学平衡常数为(可以用分数表示) ;
(4)下列改变中,能使平衡向正反应方向移动的是 。
| A.升高温度 | B.增大压强
| | C.增大H2O(g)的浓度 | D.减少CO2(g)的浓度
| (5)保持温度不变,若起始时c(CO)=1mol·L-1 , c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.4 mol·L-1。通过计算,判断此时该反应进行的方向并说明理由 。
填空题 氢气是一种清洁、高效的新型能源。
I.用甲烷制取氢气的反应分为两步,其能量变化如下图所示:

(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
II.在容积为1L的密闭容器内,加入0.1molCO和0.1molH2O,在催化剂存在的条件下高温加热使其反应。测得CO2的浓度随时间变化的图像如图:

(2)在该温度下,从反应开始至达到平衡时,CO的平均反应速率为 ;
(3)该温度下,此反应的化学平衡常数为(可以用分数表示) ;
(4)下列改变中,能使平衡向正反应方向移动的是 。
| A.升高温度 | B.增大压强
|
| C.增大H2O(g)的浓度 | D.减少CO2(g)的浓度
|
(5)保持温度不变,若起始时c(CO)=1mol·L-1 , c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.4 mol·L-1。通过计算,判断此时该反应进行的方向并说明理由
。
本题答案:(每空2分,共10分)
(1)CH4(g) + 2H2
本题解析:
试题分析:(1)根据图像可知,甲烷和水蒸气的总能量高于氢气和CO2的总能量,所以根据盖斯定律可知,该反应的反应热是ΔH=-103.3 kJ/mol-33.2 kJ/mol=—136.5 kJ/mol,则甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是CH4(g) + 2H 2O(g) = 4H2(g) + CO2(g) ΔH=—136.5 kJ/mol。
(2)根据图像可知,反应进行到10min时得到平衡状态,平衡时生成CO2的浓度是0.03mol/L,则消耗CO的浓度是0.03mol/L,所以CO的反应速率是0.03mol/L÷10s=0.003 mol·L-1·min-1。
(3)平衡时CO和水蒸气的浓度均是0.1mol/L-0.03mol/L=0.07mol/L。而生成物CO2和氢气的浓度均是0.03mol/L,所以该温度下反应的平衡常数K=
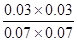
=
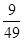
。
(4)A、正方应是放热反应,升高温度平衡向逆反应方向移动,A不正确;B、反应前后体积不变,增大氧气平衡不移动,B不正确;C、增大水蒸气的浓度,平衡向正反应方向移动,C正确;D、减小CO2的浓度,平衡向正反应方向移动,D正确;答案选CD。
(5)若起始时c(CO)=1mol·L-1 , c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.4 mol·L-1,这说明消耗CO和水蒸气的浓度均是0.4mol/L,所以平衡时CO和H 水蒸气的浓度分别是0.6mol/L和1.6mol/L,则Q=
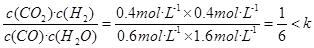
,所以该反应向正反应方向进行。
考点:考查反应热、反应速率、平衡常数的计算、外界条件对平衡状态的影响以及平衡常数的应用
本题所属考点:【影响化学反应速率的因素】
本题难易程度:【困难】
A little of everything, and nothing at all. 什么都来一点,什么也得不到.
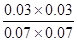 =
=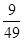 。
。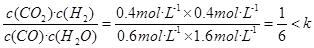 ,所以该反应向正反应方向进行。
,所以该反应向正反应方向进行。