微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (11分)H2O2是一种常用绿色氧化剂,在化学研究中应用广泛。
(1)请写出H2O2的电子式 。
(2)H2O2分解过程的能量变化如图(a)所示,
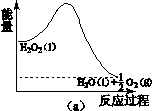
试判断该反应为 反应(吸热或放热)。
①已知:Fe3+催化H2O2分解的机理可分两步反应进行,
第一步反应为:2Fe3++H2O2=2Fe2++O2↑+2H+,
完成第二步反应的离子方程式:
 Fe2++
Fe2++  H2O2 +
H2O2 +  _________ ="="
_________ ="="  _________+
_________+  _________
_________
②按图(b)装置(A、B瓶中已充有NO2气体,2NO2(g)  N2O4(g), ΔH<0)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),原因是 。
N2O4(g), ΔH<0)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),原因是 。

(3)空气阴极法电解制备H2O2的装置如图(c)所示,主要原理是在碱性电解质溶液中,利用空气中O2在阴极反应得到H2O2和稀碱的混合物。
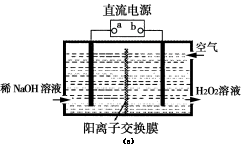
试回答:
①电源a极的名称是 。
②写出阴极电极反应式 ; 。
(4)用H2O2和H2SO4的混合溶液可溶解印刷电路板中的金属铜,请写出铜溶解的离子方程式 ,控制其它条件相同,印刷电路板的金属粉末用10% H2O2和3.0 mol·L-1 H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温度(℃)
| 20
| 30
| 40
| 50
| 60
| 70
| 80
|
Cu的平均溶解速率
(×10-3mol·min-1)
| 7.34
| 8.01
| 9.25
| 7.98
| 7.24
| 6.73
| 5.76
|
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是 。
填空题 (11分)H2O2是一种常用绿色氧化剂,在化学研究中应用广泛。
(1)请写出H2O2的电子式 。
(2)H2O2分解过程的能量变化如图(a)所示,

试判断该反应为 反应(吸热或放热)。
①已知:Fe3+催化H2O2分解的机理可分两步反应进行,
第一步反应为:2Fe3++H2O2=2Fe2++O2↑+2H+,
完成第二步反应的离子方程式:
 Fe2++
Fe2++  H2O2 +
H2O2 +  _________ ="="
_________ ="="  _________+
_________+  _________
_________
②按图(b)装置(A、B瓶中已充有NO2气体,2NO2(g)  N2O4(g), ΔH<0)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),原因是 。
N2O4(g), ΔH<0)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),原因是 。

(3)空气阴极法电解制备H2O2的装置如图(c)所示,主要原理是在碱性电解质溶液中,利用空气中O2在阴极反应 得到H2O2和稀碱的混合物。

试回答:
①电源a极的名称是 。
②写出阴极电极反应式 。
(4)用H2O2和H2SO4的混合溶液可溶解印刷电路板中的金属铜,请写出铜溶解的离子方程式 ,控制其它条件相同,印刷电路板的金属粉末用10% H2O2和3.0 mol·L-1 H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温度(℃)
| 20
| 30
| 40
| 50
| 60
| 70
| 80
|
Cu的平均溶解速率
(×10-3mol·min-1)
| 7.34
| 8.01
| 9.25
| 7.98
| 7.24
| 6.73
| 5.76
|
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是 。
本题答案:(11分)
(1)H2O2为共价化合物,电子式为<img onload='if(this.width>600)makesmallpic(this,600,1800);' src=) ;(2)能量变化图可知,生成物H2O和O2的能量小于反应物H2O2的能量,所以该反应为放热反应;①Fe3+作催化剂,第二步生成Fe3+,H2O2被还原为H2O,离子方程式为2Fe2++ H2O2 +2H+ ==2Fe3++2H2O ;②右侧烧杯由于H2O2分解放热水温升高,使2NO2(g)
;(2)能量变化图可知,生成物H2O和O2的能量小于反应物H2O2的能量,所以该反应为放热反应;①Fe3+作催化剂,第二步生成Fe3+,H2O2被还原为H2O,离子方程式为2Fe2++ H2O2 +2H+ ==2Fe3++2H2O ;②右侧烧杯由于H2O2分解放热水温升高,使2NO2(g)  N2O4(g), ΔH<0,平衡向逆向移,B瓶中气体颜色比A瓶中的深;(3)空气中O2在阴极反应得到H2O2,b为负极,则①电源a极的名称是正极;②阴极电极反应式O2+2e-+2H2O=H2O2+2OH- ;(4)根据元素守恒和得失电子守恒可得方程式;升高温度,H2O2分解速率加快,H2O2浓度降低,Cu的溶解速率降低。
N2O4(g), ΔH<0,平衡向逆向移,B瓶中气体颜色比A瓶中的深;(3)空气中O2在阴极反应得到H2O2,b为负极,则①电源a极的名称是正极;②阴极电极反应式O2+2e-+2H2O=H2O2+2OH- ;(4)根据元素守恒和得失电子守恒可得方程式;升高温度,H2O2分解速率加快,H2O2浓度降低,Cu的溶解速率降低。
考点:反应热、离子方程式、化学平衡、电化学
本题所属考点:【影响化学反应速率的因素】
本题难易程度:【困难】
Nothing must be done hastily but killing of fleas. 除非要捉跳蚤,作事不可匆忙.