微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
实验题 (12分)为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验。
实验一 探究铜和稀硝酸反应的产物。
实验装置如图,气密性已检查。

已知:FeSO4+NO=[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色。
(1)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是 。
(2)铜片和稀 硝酸反应的化学方程式为 。
(3)本实验A生成的气体中,若有NO2,B的实验现象为 ;若只有NO生成,B的实验现象是 。
实验二 探究铜和稀硝酸反应速率先慢后快的原因
经过实验一,测得硝酸的浓度<6 mol?L-1,只有NO生成。当铜片与5 mol?L-1硝酸反应时,开始时反应非常缓慢,一段时间后反应速率明显加快。为探究此反应的反应速率先慢后快的原因,进行如下探究:
探究一:研究反应过程的温度变化对反应速率的影响,实验所得曲线和现象记录如下图表。
时间/min
| 现象
|
0~15
| 铜表面出现气泡,但速度很慢
|
25
| 溶液有很浅的蓝色,气泡生成速度加快
|
30
| 气泡生成速度较快,均匀冒出
|
45
| 洗气瓶中可见少量淡棕色的物质
|
50
| 溶液中蓝色明显变深,洗气瓶中突显明显棕色
|
(4)获得图2数据所需的测量仪器有________________________________。
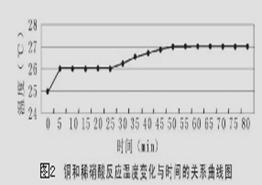
(5)从上述图表分析可得到的结论是 。
序号
| 温度
| 铜片/g
| 硝酸/mL
| 硝酸铜/g
|
1
| 25℃
| ①
| ②
| ③
|
2
| 25℃
| 5
| 20
| 0.5
|
3
| 25℃
| 5
| 20
| 1.0
|
探究二:研究化学反应产物对反应速率的影响
设计了如下实验,利用上图装置测定溶液突显明显棕色的时间。
(6)请将上表中将实验1的实验条件填写完整① ② ③
(7)通过实验发现实验1、2、3的反应速率并无明显变化,为达到实验目的还需要继续进行的实验是 。
实验题 (12分)为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验。
实验一 探究铜和稀硝酸反应的产物。
实验装置如图,气密性已检查。

已知:FeSO4+NO=[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色。
(1)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是 。
(2)铜片和稀硝酸反应的化学方程式为 。
(3)本实验A生成的气体中,若有NO2,B的实验现象为 ;若只有NO生成,B的实验现象是 。
实验二 探究铜和稀硝酸反应速率先慢后快的原因
经过实验一,测得硝酸的浓度<6 mol?L-1,只有NO生成。当铜片与5 mol?L-1硝酸反应时,开始时反应非常缓慢,一段时间后反应速率明显加快。为探究此反应的反应速率先慢后快的原因,进行如下探究:
探究一:研究反应过程的温度变化对反应速率的影响,实验所得曲线和现象记录如下图表。
时间/min
| 现象
|
0~15
| 铜表面出现气泡,但速度很慢
|
25
| 溶液有很浅的蓝色,气泡生成速度加快
|
30
| 气泡生成速度较快,均匀冒出
|
45
| 洗气瓶中可见少量淡棕色的物质
|
50
| 溶液中蓝色明显变深,洗气瓶中突显明显棕色
|
(4)获得图2数据所需的测量仪器有________________________________。

(5)从上述图表分析可得到的结论是 。
序号
| 温度
| 铜片/g
| 硝酸/mL
| 硝酸铜/g
|
1
| 25℃
| ①
| ②
| ③
|
2
| 25℃
| 5
| 20
| 0.5
|
3
| 25℃
| 5
| 20
| 1.0
|
探究二:研究化学反应产物对反应速率的影响
设计了如下实验,利用上图装置测定溶液突显明显棕色的时间。
(6)请将上表中将实验1的实验条件填写完整① ② ③
(7)通过实验发现实验1、2、3的反应速率并无明显变化,为达到实验目的还需要继续进行的实验是 。
本题答案:(1)利用生成的CO2将整个装置内的空气赶尽,避免NO和O2
本题解析:
试题分析:(1)由于装置中含有空气,能氧化生成的NO,所以实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,二者反应生成CO2,利用生成的CO2将整个装置内的空气赶尽,避免NO和O2反应生成NO2对气体产物的观察产生干扰。
(2)铜片和稀硝酸反应的化学方程式为3Cu +8HNO3(稀)=3Cu (NO3)2+2NO↑+4H2O。
(3)本实验A生成的气体中,若有NO2,NO2溶于水生成硝酸,硝酸具有强氧化性,能氧化亚铁离子为铁离子,所以B的实验现象为B瓶溶液变为棕黄色;若只有NO生成,由于FeSO4+NO=[Fe(NO)]SO4,则B的实验现象是B瓶溶液出现棕色。
(4)根据图像可知需要测量温度和时间,因此需要的仪器是温度计和秒表。
(5)根据图像可知温度升高后反应速率增加的程度不是很大,这说明反应溶液温度升高不是使反应速率加快的主要因素。
(6)要研究化学反应产物对反应速率的影响,则反应物铜片和硝酸应该是相铜的,即①中铜片质量为5g;②中硝酸的浓度是体积20ml;根据2、3可知1中硝酸铜为0。
(7)由于生成物不止一种,所以为达到实验目的还需要继续进行的实验是研究NO对反应速率的影响。
考点:考查外界条件对反应速率影响的实验方案设计与研究
本题所属考点:【影响化学反应速率的因素】
本题难易程度:【困难】
There are no faults in a thing we want badly. 我们非常想要的东西总是没有缺点的。