微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
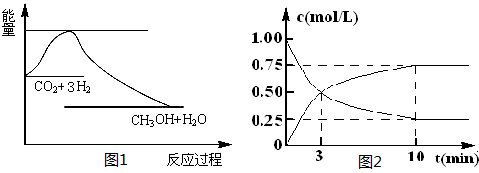
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
(1)关于该反应的下列说法中,正确的是 (填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) = ;H2的转化率w(H2) = 。
②该反应的平衡常数表达式K= 。
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g液态 甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式: 。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入和通入的物质有 ;其正极的电极反应式是: 。
填空题 实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:

(1)关于该反应的下列说法中,正确的是 (填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) = ;H2的转化率w(H2) = 。
②该反应的平衡常数表达式K= 。
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式 : 。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入和通入的物质有 ;其正极的电极反应式是: 。
本题答案:(17分) (1)C(2分)(2) ① 0.075 mol·
本题解析:
试题分析:(1)根据图1可知,该反应的反应物总能量高于生成物总能量,所以反应是放热反应,即△H<0;根据方程式可知,该反应是气体体积减小的可逆反应,因此△S<0,答案选C。
(2)①根据图2可知,反应进行到10min时,各种物质的浓度不再发生变化,反应达到平衡状态。根据图2可知,甲醇的浓度增加了0.75mol/L,所以甲醇的反应速率v(CH3OH)=0.75mol/L÷10min=0.075 mol·L-1·min-1;根据方程式可知,消耗氢气的浓度是0.75mol/L×3=2.25mol/L,所以氢气的转化率是w(H2)=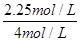 ×100%=56.25%。
×100%=56.25%。
②化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知,该反应的平衡常数表达式K=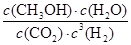 。
。
③依据化学反应的影响因素和条件逐项分析判断即可:A、反应是放热反应,升高温度平衡逆向进行;B、将CH3OH(g)及时液化抽出,减小生成物的浓度平衡正向进行;C、选择高效催化剂只能改变反应速率,不能改变化学平衡;D、再充入l molCO2和4molH2,相当于增大压强平衡正向进行;答案选BD。
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,所以1mol甲醇即32g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ×2=726.6 kJ的热量,因此该反应的热化学方程式为CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.6kJ·mol-1。
(4)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。据此可知,该原电池的负极应加入或通入的物质有甲醇、氢氧化钠、水;正极通入的是氧气,则正极电极反应式为O2+2H2O+4e-=4OH?。
考点:考查焓变和熵变、反应速率和转化率的计算、化学平衡常数、外界条件对平衡状态的影响、热化学方程式的书写以及燃料电池的有关判断和电极反应式的书写等
本题所属考点:【化学反应速率】
本题难易程度:【一般】
He is wise that is ware in time. 聪明人防患于未然。