微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (12分)工业制氢气的一个重要反应是:CO(g)+H2O(g)  CO2(g)+H2(g)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验组
| 温度℃
| 起始量/mol
| 平衡量/mol
| 达到平衡状态所需时间/min
|
CO
| H2O
| H2
| CO2
|
I
| 650
| 4
| 2
| 1.6
| 1.6
| 5
|
II
| 900
| 2
| 1
| 0.5
| 0.5
| 3
|
①对于反应CO(g)+H2O(g)  CO2(g)+H2(g),下列说法正确的是
CO2(g)+H2(g),下列说法正确的是
A.当容器中CO的含量保持不变时,说明该反应达到平衡状态
B.若混合气体的密度不再改变,说明该反应已达化学平衡状态
C.实验I中,反应达到平衡后,再通入4molCO和2molH2O,平衡正向移动,H2的体积分数增大
D.若使用催化剂,会改变反应的途径,但反应的焓变不变
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率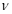 (CO)= ;
(CO)= ;
③实验II条件下反应的平衡常数K= (保留小数点后二位);H2O(g)的平衡转化率为 。
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1.5molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则平衡向 方向移动(填“正反应”、“逆反应”或“不移动”)
⑤若仅改变温度,纵坐标y随T变化如图所示,则纵坐标y表示的是 。
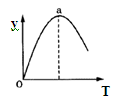
A.CO2的百分含量 B.混合气体的平均相对分子质量
C.CO的转化率 D.H2O的物质的量
填空题 (12分)工业制氢气的一个重要反应是:CO(g)+H2O(g)  CO2(g)+H2(g)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验组
| 温度℃
| 起始量/mol
| 平衡量/mol
| 达到平衡状态所需时间/min
|
CO
| H2O
| H2
| CO2
|
I
| 650
| 4
| 2
| 1.6
| 1.6
| 5
|
II
| 900
| 2
| 1
| 0.5
| 0.5
| 3
|
①对于反应CO(g)+H2O(g)  CO2(g)+H2(g),下列说法正确的是
CO2(g)+H2(g),下列说法正确的是
A.当容器中CO的含量保持不变时,说明该反应达到平衡状态
B.若混合气体的密度不再改变,说明该反应已达化学平衡状态
C.实验I中,反应达到平衡后,再通入4molCO和2molH2O,平衡正向移动,H2的体积分数增大
D.若使用催化剂,会改变反应的途径,但反应的焓变不变
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率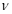 (CO)= ;
(CO)= ;
③实验II条件下反应的平衡常数K= (保留小数点后二位);H2O(g)的平衡转化率为 。
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1.5molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则平衡向 方向移动(填“正反应”、“逆反应”或“不移动”)
⑤若仅改变温度,纵坐标y随T变化如图所示,则纵坐标y表示的是 。

A.CO2的百分含量 B.混合气体的平均相对分子质量
C.CO的转化率 D.H2O的物质的量
本题答案:(1)AD; (2)0.16mo 91EXAM.orgl/l/min;(
本题解析:
试题分析:①A.若容器中CO的含量保持不变,则其浓度不变,反应处于平衡状态,正确; B.由于容器的容积不变,根据质量守恒,气体的总质量不变,所以无论反应进行到任何程度,容器中混合气体的密度都不变,因此不能判断反应处于平衡状态,错误;C.体积不变,再通入4molCO和2molH2O,相当于增大压强,平衡不移动,错误;D.使用催化剂,会改变反应的途径,但反应的焓变不变,正确。②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率V(CO)=(1.6mol÷2L)÷5min=0.16mol/(L·min); ③实验II条件下反应的平衡常数K=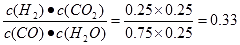 ;H2O(g)的平衡转化率=
;H2O(g)的平衡转化率=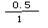 ×100
×100
本题所属考点:【化学反应速率】
本题难易程度:【困难】
The secret of success is constancy of purpose. 成功的秘诀是目标坚定.