微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (16分)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式,并在方框内填上系数。
□C+□KMnO4+□H2SO4=□CO2↑+□MnSO4 +□K2SO4+□
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)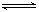 CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
实验组
| 温度℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
CO
| H2O
| H2
| CO
|
1
| 650
| 4
| 2
| 1.6
| 2.4
| 6
|
2
| 900
| 2
| 1
| 0.4
| 1.6
| 3
|
①实验1条件下,反应从开始至达到平衡,以v(CO2)表示的反应速率为 (保留小数点后二位数,下同)。
②实验2条件下平衡常数K= ,该反应为 (填“吸热”或“放热”)反应。
(3)已知在常温常压下:
①2CH3OH(l) +3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1275.6 kJ/mol
②2CO (g)+ O2(g)=2CO2(g) ΔH2=-566.0 kJ/mol
③H2O(g)=H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: & #160; 。
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
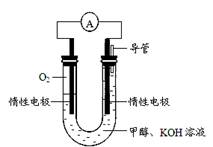
该电池正极的电极反应式为 ;该电池工作时,溶液中的OH-向 (填“正”或“负”)极移动。
填空题 (16分)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式,并在方框内填上系数。
□C+□KMnO4+□H2SO4=□CO2↑+□MnSO4 +□K2SO4+□
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)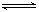 CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
实验组
| 温度℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
CO
| H2O
| H2
| CO
|
1
| 650
| 4
| 2
| 1.6
| 2.4
| 6
|
2
| 900
| 2
| 1
| 0.4
| 1.6
| 3
|
①实验1条件下,反应从开始至达到平衡,以v(CO2)表示的反应速率为 (保留小数点后二位数,下同)。
②实验2条件下平衡常数K= ,该反应为 (填“吸热”或“放热”)反应。
(3)已知在常温常压下:
①2CH3OH(l) +3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1275.6 kJ/mol
②2CO (g)+ O2(g)=2CO2(g) ΔH2=-566.0 kJ/mol
③H2O(g)=H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。

该电池正极的电极反应式为 ;该电池工作时,溶液中的OH-向 (填“正”或“负”)极移动。
本题答案:(1)5C+4KMnO4 +6 H2SO4=5CO2↑+4M
本题解析:
试题分析:(1)高锰酸钾中锰元素化合价降低(+7)-(+2)=5价,碳元素化合价升高0-(-4)=4价,化合价升降守恒,所以高锰酸钾前的系数是4,碳单质前的系数是5,根据原子守恒,二氧化碳前是5,硫酸锰前是4,硫酸钾前面是2,根据硫酸跟守恒,所以硫酸前面是6,据氧原子和氢原子守恒,产物少6个水分子,故方程式为:5C+4KMnO4 +6 H2SO4=5CO2↑+4MnSO4+2K2SO4+6H2O;(2)①、由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,v(CO)=1.6mol÷2L÷6min=0.13mol/(L·min);速率之比等于化学计量数之比,故v(CO2)=v(CO)=0.13mol/(L?min);③、平衡时CO的物质的量为1.6mol,则可列三段式
CO(g)+ H2O(g)? CO2(g)+ H2(g),
开始(mol):2 1 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
该反应前后气体体积不变,故利用物质的量代替浓度计算平衡常数,故900℃时该反应平衡常数k=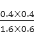 =0.17,则该反应为放热反应(2)已知:①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1)△H=-1275.6kJ/mol,②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol,③ H2O(g)=H2O(l) ΔH3=-44.0 kJ/mol根据盖斯定律,①-②得2CH3OH(1)+2O2(g)=2CO(g)+4H2O(g),故△H=(-1275.6kJ/mol)-(-566.0kJ/mol)="-709.6" kJ/mol即CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-354.8kJ/mol,(3)①电池反应原理甲醇发生氧化反应,在负极放电,氧气发生还原反应,在正极放电,反应式为O2+4e-+2H2O=4OH-,②负极失电子产生大量正电荷,则该电池工作时,溶液中的OH-向负极。
=0.17,则该反应为放热反应(2)已知:①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1)△H=-1275.6kJ/mol,②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol,③ H2O(g)=H2O(l) ΔH3=-44.0 kJ/mol根据盖斯定律,①-②得2CH3OH(1)+2O2(g)=2CO(g)+4H2O(g),故△H=(-1275.6kJ/mol)-(-566.0kJ/mol)="-709.6" kJ/mol即CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-354.8kJ/mol,(3)①电池反应原理甲醇发生氧化反应,在负极放电,氧气发生还原反应,在正极放电,反应式为O2+4e-+2H2O=4OH-,②负极失电子产生大量正电荷,则该电池工作时,溶液中的OH-向负极。
考点:化学反应原理。
本题所属考点:【化学反应速率】
本题难易程度:【一般】
Honesty is the best policy. 诚实为上策.