|
|
|
为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转?【热化学方程式】
2016-12-26 21:20:39
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g) △H=-566kJ·moL-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ·moL-1
H2O (g)=H2O(l) △H=-44.0KJ·moL-1
(1)氢气的标准燃烧热△H= kJ·moL-1
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式 &# 160;
(3)往 1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为 ;反应达到平衡后,升高温度,此时平衡常数将 (填“变大”、“不变”或“变小”),平衡将向 (填“正”或“逆”)方向移动。
(4)在CO和H2O反应转化为绿色能源H2中,为了提高CO的转化率,可采取的措施是 。
A.增大的CO浓度
B.增大的H2O(g)浓度
C.使用催化剂
D.降低温度
|
填空题 为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g) △H=-566kJ·moL-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ·moL-1
H2O (g)=H2O(l) △H=-44.0KJ·moL-1
(1)氢气的标准燃烧热△H= kJ·moL-1
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式
(3)往 1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为 ;反应达到平衡后,升高温度,此时平衡常数将 (填“变大”、“不变”或“变小”),平衡将向 (填“正”或“逆”)方向移动。
(4)在CO和H2O反应转化为绿色能源H2中,为了提高CO的转化率,可采取的措施是 。
A.增大的CO浓度
B.增大的H2O(g)浓度
C.使用催化剂
D.降低温度
|
本题答案:(共11分)(1)-285.8(2分)
(2)CO(g
本题解析:
试题分析:(1)通常条件下,1mol氢气完全燃烧生成液态水放出的热量为氢气的燃烧热。已知反应①2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ·moL-1、②H2O (g)=H2O(l) △H=-44.0KJ·moL-1,则根据盖斯定律可 知,①×
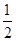
+②即得到反应H2(g)+
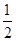
O2(g)=H2O(g),所以该反应的△H=-483.6KJ?moL-1÷2+-44.0KJ·moL-1=-285.8KJ?moL-1,即氢气的标准燃烧热△H=-285.8KJ?moL-1。
(2)已知反应①2CO(g)+O2(g)=2CO2(g) △H=-566kJ·moL-1、②2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ·moL-1,则根据盖斯定律可知,(①-②)÷2即得到反应CO(g)+H2O(g)=CO2(g)+H2(g) ,所以该反应的分液△H=(-566kJ·moL-1+483.6KJ·moL-1)÷2=-41.2kJ/mol。(3)(3)令参加反应的CO的物质的量浓度为nmol/L,则:
CO(g)+H2O(g)

CO2(g)+H2(g)
起始浓度(mol/L)1 1 0 0
转化浓度(mol/L)n n n n
平衡浓度(mol/L)1-n 1-n n n
所以根据平衡常数可知K=

=
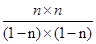
=1
解得n=0.5mol/L
所以t℃时CO的转化率为
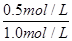
×100%=50%
由(2)可知该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数变小。
(4)A、增大的CO浓度,平衡向正反应移动,但CO的转化率降低,故A错误;B、增大的H2O(g)浓度,平衡向正反应移动,但CO的转化率增大,故B正确;C、使用催化剂加快反应速率,平衡不移动,CO转化率不变,故C错误;D、降低温度平衡向正反应移动,但CO的转化率增大,故D正确,答案选BD。
考点:考查燃烧热计算、热化学方程式的书写;外界条件对平衡状态的影响;平衡常数的计算和应用等
本题所属考点:【热化学方程式】
本题难易程度:【困难】
Fair words fill not the belly. 甜言蜜语填不饱肚子。
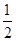 +②即得到反应H2(g)+
+②即得到反应H2(g)+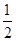 O2(g)=H2O(g),所以该反应的△H=-483.6KJ?moL-1÷2+-44.0KJ·moL-1=-285.8KJ?moL-1,即氢气的标准燃烧热△H=-285.8KJ?moL-1。
O2(g)=H2O(g),所以该反应的△H=-483.6KJ?moL-1÷2+-44.0KJ·moL-1=-285.8KJ?moL-1,即氢气的标准燃烧热△H=-285.8KJ?moL-1。 CO2(g)+H2(g)
CO2(g)+H2(g) =
=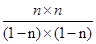 =1
=1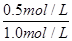 ×100%=50%
×100%=50%