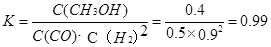|
|
|
甲醇是一种常用的燃料,工业上可以用CO和H2在一定条件下合成甲醇【热化学方程式】
2016-12-26 21:22:30
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 甲醇是一种常用的燃料,工业上可以用CO和H2在一定条件下合成甲醇。
(1)已知CO(g)、H2(g)、CH3OH(1)的燃烧热△H分别为:-283.0kJ/mol、-285.8 kJ/mol、-726.5kJ/mol,则CO合成甲醇的热化学方程式为: 。
(2)在恒容密闭容器中CO与H2发生反应生成甲醇,各物质浓度在不同条件下的变化状况如图所示(开始时氢气的浓度曲线和8分钟后甲醇的浓度曲线未画出。4分钟和8分钟改变的条件不同):
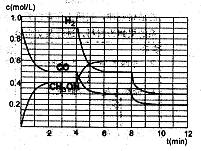
①下列说法正确的是
A.起始时n(H2)为1.7mol
B.当容器内压强恒定时,说明反应达到平衡状态
C.4分钟时,改变的条件是升高温度
D.7分钟时,v(CO)=v(CH3OH)
| ②计算0~2min内平均反应速率v(H2)=
③在3min时该反应的平衡常数K= (计算结果)
④在图中画出8~12min之间c(CH3OH)曲线
(2)2009年,中国在甲醇燃料电池技术上获得突破,组装了自呼吸电池及主动式电堆,其装置原理如图甲。

①该电池的负极反应式为: 。
②乙池是一铝制品表面“钝化”装置,两极分别为铝制品和石墨。
M电极的材料是 ,该铝制品表面“钝化”时的反应式为: 。
填空题 甲醇是一种常用的燃料,工业上可以用CO和H2在一定条件下合成甲醇。
(1)已知CO(g)、H2(g)、CH3OH(1)的燃烧热△H分别为:-283.0kJ/mol、-285.8 kJ/mol、-726.5kJ/mol,则CO合成甲醇的热化学方程式为: 。
(2)在恒容密闭容器中CO与H2发生反应生成甲醇,各物质浓度在不同条件下的变化状况如图所示(开始时氢气的浓度曲线和8分钟后甲醇的浓度曲线未画出。4分钟和8分钟改变的条件不同):

①下列说法正确的是
A.起始时n(H2)为1.7mol
B.当容器内压强恒定时,说明反应达到平衡状态
C.4分钟时,改变的条件是升高温度
D.7分钟时,v(CO)=v(CH3OH)
|
②计算0~2min内平均反应速率v(H2)=
③在3min时该反应的平衡常数K=
(计算结果)
④在图中画出8~12min之间c(CH3OH)曲线
(2)2009年,中国在甲醇燃料电池技术上获得突破,组装了自呼吸电池及主动式电堆,其装置原理如图甲。

①该电池的负极反应式为:
。
②乙池是一铝制品表面“钝化”装置,两极分别为铝制品和石墨。
M电极的材料是
,该铝制品表面“钝化”时的反应式为:
。
本题答案:化学反应式或方程式未配平的均扣1分
(1)CO(g)+
本题解析:
试题分析:(1)先写出三种物质的燃烧热的热化学方程式。
① CO(g)
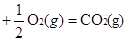
△H1=-283.0kJ/mol
② H2(g)+
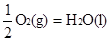
△H2=-285.8 kJ/mol
③ CH3OH(1)+
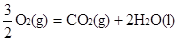
△H3=-726.5kJ/mol
再写出目标方程式:CO(g)+2H2(g)=CH3OH(l) △H4
根据盖斯定律, ①+②×2-③即得到目标方程式。 △H4= △H1+△H2×2-△H3=-128.1kJ/mol
根据图像: CO(g)+2H2(g)=CH3OH(l)
起始:(mol/L) 0.9 x 0
0-2min(mol/L) —0.4 —0.8 0.4
2-4min(mol/L)(平衡) 0.5 0.9 0.4
4-6min(mol/L) —0.2 —0.4 0.2
6-8min(mol/L)(平衡) 0.3 0.5 & #160; 0.6
8-10min(mol/L) —0.1 —0.2 0.1
10-12min(mol/L)(平衡)0.2 0.3 y
①A项,起始时浓度x=C(H2)为1.7mol/L,容器体积未知,所以物质的量也未知,A项错误。
B项,该容器是一个恒容的容器,反应是一个非等体积反应,因此当气体的总物质的量不再改变,即压强不再改变,反应即达到平衡状态,正确。
C项,4min时,平衡向右移,并且各物质的浓度是逐渐变化,所以应该是降温的条件下,C项错误。
D项,7min时,反应再次达到平衡,此时v(CO)=v(CH3OH),D项正确。
②0~2min内平均反应速率v(H2)=
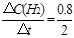
="0.4" mol·L-1·min-1
③在3min时该反应的平衡常数
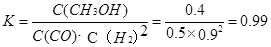
④在第8min时,CO的浓度减少0.1mol·L-1,H2的浓度减少0.2mol·L-1,可知平衡在向右移动,CO和H2的浓度都是逐渐变小,而此时的条件和上次平衡移动的条件不相同,所以只能是减少甲醇的浓度,才能使平衡向右移动,即在平衡移动的瞬间,甲醇的浓度是很少的,应该要低于0.05mol·L-1,然后再增加0.1mol·L-1,在第10min平衡,并且浓度y不超过0.15mol·L-1。
(3)该装置中甲是一个燃料电池装置,给右边的装置乙提供电能,乙装置是一个电解池装置。
①甲中质子移向右边,从而推知甲装置左是负极,右是正极,则乙装置中M是阳极,N是阴极。甲中电池的负极反应式为:CH3OH-6e-+H2O=CO2↑+6 H+ 要注意电解质溶液质子在进行传递。
②乙池是一铝制品表面“钝化”装置,两极分别为铝制品和石墨。则阳极M材料是铝制品,阴极N材料是石墨。在铝表面钝化,即把铝变成Al2O3,同时考虑溶液中溶质为NaHCO3,则电极反应为:2Al-6e-+6HCO3-=Al2O3+6CO2↑+3H2O
考点: 考查热化学方程式的书写、化学平衡原理及其图像问题、电化学综合。
本题所属考点:【热化学方程式】
本题难易程度:【困难】
He that plants trees loves others besides himself. 植树的人,不但爱已,而且爱人.


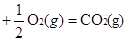 △H1=-283.0kJ/mol
△H1=-283.0kJ/mol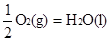 △H2=-285.8 kJ/mol
△H2=-285.8 kJ/mol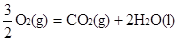 △H3=-726.5kJ/mol
△H3=-726.5kJ/mol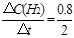 ="0.4" mol·L-1·min-1
="0.4" mol·L-1·min-1