|
|
|
雾霾已经严重影响我们的生存环境。火力发电厂释放出大量的氮氧化【热化学方程式】
2016-12-26 21:25:46
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 雾霾已经严重影响我们的生存环境。火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。
 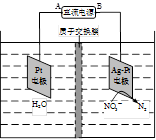
图22-1 图22-2 图22-3
(1)利用甲烷催化还原NOx:
①CH4(g) + 4NO2(g) =" 4NO(g)" + CO2(g) + 2H2O(g) △H1=-574kJ?mol-1
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)将CO2转化为甲醇的热化学方程式为:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线(见图22-1),则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图22-2所示。
下列说法正确的是 (填字母代号)。
A.第10min后,向该容器中再充入1molCO2和3molH2,则再次达到平衡时c(CH3OH) ="1.5" mol/L
B.达到平衡时,氢气的转化率为0.75
C.0~10分钟内,氢气的平均反应速率为0.075mol/(L?min)
D.该温度下,反应的平衡常数的值为3/16
| E.升高温度将使n(CH3OH)/n(CO2)增大
(3)某种脱硫工艺中将烟气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程为 。
(4)电化学降解NO3- 的原理如题22-3图所示。
①电源正极为 (填“A”或“B”),阴极反应式为 。
②若电解过程中转移了1mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为 g。
填空题 雾霾已经严重影响我们的生存环境。火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。
 
图22-1 图22-2 图22-3
(1)利用甲烷催化还原NOx:
①CH4(g) + 4NO2(g) =" 4NO(g)" + CO2(g) + 2H2O(g) △H1=-574kJ?mol-1
②CH4(g 91exam .org) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)将CO2转化为甲醇的热化学方程式为:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线(见图22-1),则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图22-2所示。
下列说法正确的是 (填字母代号)。
A.第10min后,向该容器中再充入1molCO2和3molH2,则再次达到平衡时c(CH3OH) ="1.5" mol/L
B.达到平衡时,氢气的转化率为0.75
C.0~10分钟内,氢气的平均反应速率为0.075mol/(L?min)
D.该温度下,反应的平衡常数的值为3/16
|
E.升高温度将使n(CH3OH)/n(CO2)增大
(3)某种脱硫工艺中将烟气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程为
。
(4)电化学降解NO3- 的原理如题22-3图所示。
①电源正极为
(填“A”或“B”),阴极反应式为
。
②若电解过程中转移了1mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为
g。
本题答案:(1)CH4(g)+2NO2(g)=N2(g)+CO2(g)
本题解析:
试题分析:(1)(①+②)÷2可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ?mol-1
(2)① 由甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线可以看出:当升高温度时甲醇的体积分数减小,说明升高温度化学平衡向逆反应方向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应反应移动,逆反应方向是吸热反应,所以正反应为放热反应,所以△H<0.② CO2(g) + 3H2(g) = CH3OH(g) + H2O(g)由图可知:反应的容器容积为1L,当反应进行到10分钟时达到平衡,此时CO2的转化率为0.75. CH3OH的平衡浓度为0.75mol/L.A. 此时若向该容器中再充入1mol CO2和3mol H2,假如平衡不发生移动,由于C(CO2)C(H2)都是原来的2倍,则再次达到平衡时c(CH3OH) ="1.5" mol/L。而实质上这是一个反应前后气体体积不等的可逆反应,增大反应物的浓度,也就增大了压强。增大压强化学平衡向气体体积减小的方向即正反应方向移动。所以当达到新的平衡时c(CH3OH)大于1.5 mol/L。错误。B.由于在反应中CO2和H2是按照1:3关系反应的,投入量也是按照1:3加入的,所以再次达到平衡时,氢气的转化率不变,仍为0.75。正确。C.0~10分钟内,V(CO2)= ΔC/Δt="0.75mol/L÷10min=" 0.075mol/( L?min) .V(H2): V(CO2)=3:1,所以V(H2) ="3" V(CO2)= 3×0.075mol/( L?min) = 0.225mol/( L?min).错误。D.该温度下,反应的平衡常数的值K="{" c(CH3OH)·c(H2O)}÷{ c(CO2)·c3(H2)}=" (0.75×0.75)" ÷{0.25×(3-0.75)3}=0.1975.错误.E.由于该反应的正反应是放热反应,所以升高温度将使平衡逆向移动,n(CH3OH)/n(CO2)减小。错误。正确选项为B。(3)该反应的化学方程为12NH3+3O2+4SO2+ 4NO2+6H2O= 4(NH4)2SO4+4NH4NO3(4)① 由于NO3- →N2 ,得到电子,所以应该接电源的负极,作阴极。即A为电源的正极,B为电源的负极。阴极反应式为2NO3-+10e-+6H2O=N2↑+12OH-。② 电解池右侧NO3-转化成N2,发生还原反应:2 NO3-+10e-+6H2O = N2↑+ 12OH- ,其电极应为阴极,则左侧发生 氧化反应:2H2O
本题所属考点:【热化学方程式】
本题难易程度:【困难】
Times change. 时代在改变.