微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 短周期元素A、X、D、E、R、T原子序数依次增大,原子结构及性质如表所示:
元素
| 结构及性质
|
A
| A的原子半径最小
|
X
| X原子最外层电子数是次外层的两倍
|
D
| D是短周期中金属性最强的元素
|
E
| E的最高价氧化物对应水化物是一种常见的两性氢氧化物
|
R
| R与X同主族
|
T
| T的负一价阴离子的核外电子排布与Ar原子相同
|
(1)R元素在周期表的位置是 ,化合物DT中存在的化学键是 。
(2)写出E单质与NaOH溶液反应的离子方程式 。
(3)1g X2A4 完全燃烧,恢复到常温时放出a kJ的热量,写出X2A4完全燃烧的热化学方程式 ; 。
(4)RT4极易水解生成两种酸,写出该反应的化学方程式 。
(5)已知某温度下T的某一元含氧酸的Ka = 4.0×10-8,若一定浓度该酸的pH=4,则此溶液的物质的量浓度为 。
填空题 短周期元素A、X、D、E、R、T原子序数依次增大,原子结构及性质如表所示:
元素
| 结构及性质
|
A
| A的原子半径最小
|
X
| X原子最外层电子数是次外层的两倍
|
D
| D是短周期中金属性最强的元素
|
E
| E的最高价氧化物对应水化物是一种常见的两性氢氧化物
|
R
| R与X同主族
|
T
| T的负一价阴离子的核外电子排布与Ar原子相同
|
(1)R元素在周期表的位置是 & #160; ,化合物DT中存在的化学键是 。
(2)写出E单质与NaOH溶液反应的离子方程式 。
(3)1g X2A4 完全燃烧,恢复到常温时放出a kJ的热量,写出X2A4完全燃烧的热化学方程式 。
(4)RT4极易水解生成两种酸,写出该反应的化学方程式 。
(5)已知某温度下T的某一元含氧酸的Ka = 4.0×10-8,若一定浓度该酸的pH=4,则此溶液的物质的量浓度为 。
本题答案:(1)第三周期Ⅳ族(1分) 离子键(1分)
本题解析:
试题分析:A的原子半径最小,则A为H元素;X原子最外层电子数是次外层的两倍,则X为C元素;D是短周期中金属性最强的元素,则D为Na元素;E的最高价氧化物对应水化物是一种常见的两性氢氧化物,则E为Al元素;R与X同主族,则R为Si元素;T的负一价阴离子的核外电子排布与Ar原子相同,则T为Cl元素。
(1)R为Si元素,在元素周期表中位于第三周期Ⅳ族;化合物DT为NaCl,含有离子键。
(2)E为Al,与NaOH溶液反应的离子方程式为:2Al+2OH?+2H2O = 2AlO2-+3H2↑
(3)X2A4 为C2H4,1g C2H4完全燃烧,恢复到常温时放出a kJ的热量,则1mol C2H4即28g完全燃烧,恢复到常温时放出28a kJ的热量,可得热化学方程式:C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ?H=" -" 28a kJ?mol-1
(4)RT4为SiCl4,水解生成的两种酸为H2SiO3和HCl,或H4SiO4和HCl,所以水解方程式为:SiCl4+3H2O =H2SiO3↓4HCl↑ (或SiCl4+4H2O 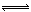 H4SiO4↓+4HCl↑)
H4SiO4↓+4HCl↑)
(5)该酸的pH=4,则该酸电离出的H+浓度为10-4mol?L?1,设该酸的物质的量浓度为C,根据电离平衡常数可得:Ka =10-4×10-4÷(c-10-4)= 4.0×10-8,解得c=0.25mol?L?1
考点:本题考查元素的推断、方程式的书写、化学键的判断、电离平衡常数的计算。
本题所属考点:【热化学方程式】
本题难易程度:【困难】
Industry is fortune's right hand, and frugality her left. 节俭和勤奋是幸运的左右手.