|
|
|
利用太阳能分解水生成的氢气,在催化剂作用下氢气与二氧化碳反应【热化学方程式】
2016-12-26 22:35:09
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 利用太阳能分解水生成的氢气,在催化剂作用下氢气与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
(1)用太阳能分解10 mol水消耗的能量是 kJ。
(2)液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为 91EXAm.org 。
(3) 在容积为2 L的密闭容器中,由CO2和H2合成甲醇,反应式:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃): CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):

①可逆反应的平衡常数表达式K=
②下列说法正确的是
A.温度为T1时,从反应开始到平衡,生成甲醇
的平均速率为v(CH3OH)= mol·L-1·min-1 mol·L-1·min-1
B.该反应在T1时的平衡常数比T2时的小
C.该反应为放热反应
D.处于A点的反应体系从T1变到T2,达到平衡时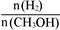 增大 增大
| ③在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为 ;
(4) 在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,总反应式为
2CH3OH + 3O2=2CO2+4H2O,则正极的反应式为 ;
负极的反应式为 。[来
填空题 利用太阳能分解水生成的氢气,在催化剂作用下氢气与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
(1)用太阳能分解10 mol水消耗的能量是 kJ。
(2)液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为 。
(3) 在容积为2 L的密闭容器中,由CO2和H2合成甲醇,反应式:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃): CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):

①可逆反应的平衡常数表达式K=
②下列说法正确的是
A.温度为T1时,从反应开始到平衡,生成甲醇
的平均速率为v(CH3OH)= mol·L-1·min-1 mol·L-1·min-1
B.该反应在T1时的平衡常数比T2时的小
C.该反应为放热反应
D.处于A点的反应体系从T1变到T2,达到平衡时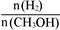 增大 增大
|
③在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为
;
(4) 在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,总反应式为
2CH3OH + 3O2=2CO2+4H2O,则正极的反应式为
;
负极的反应式为
。[来
本题答案:(1)2858 (2)CH3OH(l)
本题解析:
试题分析:(1)1摩尔的氢气完全燃烧产生稳定的氧化物放出热量为285.8 kJ.则1mol的水分解产生1mol的氢气吸收热量285.8 kJ,则分解10 mol水吸收的能量是2858 kJ。(2) CO燃烧的热化学方程式为:①CO(g)+1/2O2(g)=CO2(g) △H="-283kl/mol;" 液态甲醇完全燃烧的热化学方程式为:②CH3OH(l)+3/2(g)=CO2(g)+ +2H2O(l) △H=-726kl/mol②-①整理得CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=" -" 443.5KJ/mol. (3) ①可逆反应的平衡常数表达式K=
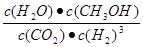
.②A 温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=

.错误。B 由于在T1达到平衡时甲醇的物质的量浓度比在T2时大,说明平衡时K1>K2.错误。C.由于在温度为T2时先达到平衡,说明T2>T1。升高温度,甲醇的含量降低,说明平衡逆向移动。根据平衡移动原理,升高温度,化学平衡向吸热方向移动,故正反应为放热反应。正确。D. 处于A点的反应体系从T1升高到T2,达到平衡时n(H2) 增大,n(CH3OH)减小,所以n(H2)/n(CH3OH) 增大。正确。正确选项为CD。③开始时通入1 mol CO2和3 mol H2,充分反应达到平衡后,若CO2的转化率为α,则达到平衡时充分反应达到平衡后,若CO2为(1-α)mol, H2为3(1-α)mol, n(CH3OH)=" α" mol, n(H2O)=" α" mol. 由于是在一密闭恒容容器中,所以容器内的压强与起始压强之比为为反应前后的气体的物质的量的比。平衡时气体的物质的量为(1-α)mol+3(1-α)mol+α mol+ α mol.=(4-2α)mol,开始时气体的物质的量为4mol。故容器内的压强与起始压强之比为(4-2α)mol:4mol=
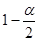
。(4) 以甲醇为燃料的燃料电池中,电解质溶液为酸性,电 池的总反应式为2CH3OH + 3O2=2CO2+4H2O。通入甲醇的电极为负极,负极的反应式为CH3OH+H2O-6e-=CO2+6H+;通入氧气的电极为正极,正极的反应式O2+4H++4e-=2H2O
考点:考查热化学方程式的书写、外界条件对化学平衡的影响、化学平衡常数的计算、表达及燃料电池的反应原理等知识,
本题所属考点:【热化学方程式】
本题难易程度:【困难】
An ounce of discretion is worth a pound of wit. 一盎司慎重等于一磅机智。
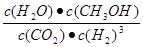 .②A 温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=
.②A 温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=  .错误。B 由于在T1达到平衡时甲醇的物质的量浓度比在T2时大,说明平衡时K1>K2.错误。C.由于在温度为T2时先达到平衡,说明T2>T1。升高温度,甲醇的含量降低,说明平衡逆向移动。根据平衡移动原理,升高温度,化学平衡向吸热方向移动,故正反应为放热反应。正确。D. 处于A点的反应体系从T1升高到T2,达到平衡时n(H2) 增大,n(CH3OH)减小,所以n(H2)/n(CH3OH) 增大。正确。正确选项为CD。③开始时通入1 mol CO2和3 mol H2,充分反应达到平衡后,若CO2的转化率为α,则达到平衡时充分反应达到平衡后,若CO2为(1-α)mol, H2为3(1-α)mol, n(CH3OH)=" α" mol, n(H2O)=" α" mol. 由于是在一密闭恒容容器中,所以容器内的压强与起始压强之比为为反应前后的气体的物质的量的比。平衡时气体的物质的量为(1-α)mol+3(1-α)mol+α mol+ α mol.=(4-2α)mol,开始时气体的物质的量为4mol。故容器内的压强与起始压强之比为(4-2α)mol:4mol=
.错误。B 由于在T1达到平衡时甲醇的物质的量浓度比在T2时大,说明平衡时K1>K2.错误。C.由于在温度为T2时先达到平衡,说明T2>T1。升高温度,甲醇的含量降低,说明平衡逆向移动。根据平衡移动原理,升高温度,化学平衡向吸热方向移动,故正反应为放热反应。正确。D. 处于A点的反应体系从T1升高到T2,达到平衡时n(H2) 增大,n(CH3OH)减小,所以n(H2)/n(CH3OH) 增大。正确。正确选项为CD。③开始时通入1 mol CO2和3 mol H2,充分反应达到平衡后,若CO2的转化率为α,则达到平衡时充分反应达到平衡后,若CO2为(1-α)mol, H2为3(1-α)mol, n(CH3OH)=" α" mol, n(H2O)=" α" mol. 由于是在一密闭恒容容器中,所以容器内的压强与起始压强之比为为反应前后的气体的物质的量的比。平衡时气体的物质的量为(1-α)mol+3(1-α)mol+α mol+ α mol.=(4-2α)mol,开始时气体的物质的量为4mol。故容器内的压强与起始压强之比为(4-2α)mol:4mol=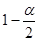 。(4) 以甲醇为燃料的燃料电池中,电解质溶液为酸性,电 池的总反应式为2CH3OH + 3O2=2CO2+4H2O。通入甲醇的电极为负极,负极的反应式为CH3OH+H2O-6e-=CO2+6H+;通入氧气的电极为正极,正极的反应式O2+4H++4e-=2H2O
。(4) 以甲醇为燃料的燃料电池中,电解质溶液为酸性,电 池的总反应式为2CH3OH + 3O2=2CO2+4H2O。通入甲醇的电极为负极,负极的反应式为CH3OH+H2O-6e-=CO2+6H+;通入氧气的电极为正极,正极的反应式O2+4H++4e-=2H2O