|
|
|
下列热化学方程式正确的是 ( )&#【热化学方程式】
2016-12-26 22:59:04
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 下列热化学方程式正确的是 ( )
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)  2NH3(g) ΔH=-38.6 kJ·mol-1 2NH3(g) ΔH=-38.6 kJ·mol-1
C.已知在101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为
H2(g)+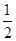 O2(g)===H2O(g) ΔH=-242 kJ·mol-1 O2(g)===H2O(g) ΔH=-242 kJ·mol-1
D.25 ℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,硫酸溶液与氢氧化钾溶液反应的中和热的热 化学方程式为
| H2SO4(aq)+2KOH(aq)===K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
选择题 下列热化学方程式正确的是 ( )
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)  2NH3(g) ΔH=-38.6 kJ·mol-1 2NH3(g) ΔH=-38.6 kJ·mol-1
C.已知在101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为
H2(g)+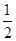 O2(g)===H2O(g) ΔH=-242 kJ·mol-1 O2(g)===H2O(g) ΔH=-242 kJ·mol-1
D.25 ℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,硫酸溶液与氢氧化钾溶液反应的中和热的热化学方程式为
|
H2SO4(aq)+2KOH(aq)===K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
本题答案:C
本题解析:
试题分析:A.甲烷的燃烧热为890.3 kJ/mol,表示1mol的甲烷完全燃烧产生稳定的氧化物时所放出的热量,在通常情况下,水的稳定状态是液体,不是气态,甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g) ==CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol,错误;B.氮气与氢气合 成氨的反应是可逆反应,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,发生反应的氮气的物质的量小于0.5 mol,因此热化学方程式为N2(g)+3H2(g)

2NH3(g) ΔH<-38.6 kJ/mol,错误;C.1 g H2的物质的量是0.5 mol,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+
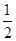
O2(g)==H2O(g) ΔH=-242 kJ/mol,正确;D.中和热为57.3 kJ/mol表示酸碱发生中和反应产生1mol的水所放出的热量,物质发生反应越多,反应放出的热量就越多,所以硫酸溶液与氢氧化钾溶液反应的中和热的热化学方程式为1/2H2SO4(aq)+KOH(aq)=== 1/2K2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol,错误。
考点:考查热化学方程式书写的正误判断的知识。
本题所属考点:【热化学方程式】
本题难易程度:【一般】
What is learned in the cradle is carried to the grave. 孩提时代学到的东西,到老死也不会忘记.
 2NH3(g) ΔH<-38.6 kJ/mol,错误;C.1 g H2的物质的量是0.5 mol,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+
2NH3(g) ΔH<-38.6 kJ/mol,错误;C.1 g H2的物质的量是0.5 mol,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+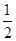 O2(g)==H2O(g) ΔH=-242 kJ/mol,正确;D.中和热为57.3 kJ/mol表示酸碱发生中和反应产生1mol的水所放出的热量,物质发生反应越多,反应放出的热量就越多,所以硫酸溶液与氢氧化钾溶液反应的中和热的热化学方程式为1/2H2SO4(aq)+KOH(aq)=== 1/2K2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol,错误。
O2(g)==H2O(g) ΔH=-242 kJ/mol,正确;D.中和热为57.3 kJ/mol表示酸碱发生中和反应产生1mol的水所放出的热量,物质发生反应越多,反应放出的热量就越多,所以硫酸溶液与氢氧化钾溶液反应的中和热的热化学方程式为1/2H2SO4(aq)+KOH(aq)=== 1/2K2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol,错误。