|
|
|
(16分)水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通?【热化学方程式】
2016-12-26 23:08:24
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (16分)水煤气(CO 和H2 )是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g) CO (g) +H2 (g) △H= +131.3 kJ?mol-1 CO (g) +H2 (g) △H= +131.3 kJ?mol-1
(1)该反应的平衡常数K随温度的升高而___________(增大 / 减小 / 不变)。
(2)上述反应达到平衡后,将体系中的C (s)全部移走,平衡_______________(向左移 / 向右移 / 不移动)。
(3)下列事实能说明该反应在一定条件下已达到平衡状态的有_______(填序号)。
A.单位体积内每消耗1 mol CO的同时生成1molH2
B.混合气体总物质的量保持不变
C.生成H2O(g)的速率与消耗CO的速率相等
D.H2O(g)、CO、H2的浓度相等
| (4)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在右图中继续画出t1时刻之后c(CO)随时间的变化。
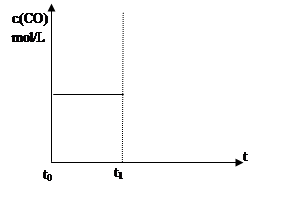
① 缩小容器体积(用实线表示)。
② 降低温度(用虚线表示)。
(5)某温度下,将6.0 mol H2O(g)和足量的炭充入2 L的密闭容器中,发生如下反应,
C (s) + H2O(g) CO (g) +H2 (g),达到平衡时测得lgK= -1.0,求此温度下H2O(g)的 CO (g) +H2 (g),达到平衡时测得lgK= -1.0,求此温度下H2O(g)的
转化率(计算结果保留3位有效数字,要求写出计算过程)。
(6)己知:① C (s) + H2O(l) CO (g) +H2 (g) △H1 CO (g) +H2 (g) △H1
② 2CO(g) + O2(g) = 2CO2 (g) △H2
③ H2O (l)= H2 (g) +1/2 O2 (g) △H3
则2C (s) + O2 (g) = 2CO2 (g)的△H= _________ ____。
填空题 (16分)水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g) CO (g) +H2 (g) △H= +131.3 kJ?mol-1 CO (g) +H2 (g) △H= +131.3 kJ?mol-1
(1)该反应的平衡常数K随温度的升高而___________(增大 / 减小 / 不变)。
(2)上述反应达到平衡后,将体系中的C (s)全部移走,平衡_______________(向左移 / 向右移 / 不移动)。
(3)下列事实能说明该反应在一定条件下已达到平衡状态的有_______(填序号)。
A.单位体积内每消耗1 mol CO的同时生成1molH2
B.混合气体总物质的量保持不变
C.生成H2O(g)的速率与消耗CO的速率相等
D.H2O(g)、CO、H2的浓度相等
|
(4)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在右图中继续画出t1时刻之后c(CO)随时间的变化。
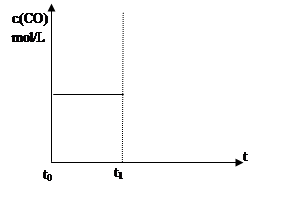
① 缩小容器体积(用实线表示)。
② 降低温度(用虚线表示)。
(5)某温度下,将6.0 mol H2O(g)和足量的炭充入2 L的密闭容器中,发生如下反应,
C (s) + H2O(g)

CO (g) +H2 (g),达到平衡时测得lgK= -1.0,求此温度下H2O(g)的
转化率(计算结果保留3位有效数字,要求写出计算过程)。
(6)己知:① C (s) + H2O(l)

CO (g) +H2 (g) △H1
② 2CO(g) + O2(g) = 2CO2 (g) △H2
③ H2O (l)= H2 (g) +1/2 O2 (g) △H3
则2C (s) + O2 (g) = 2CO2 (g)的△H= _________
____。
本题答案:(16分)
(1)增大(2分)。(2)向左移(2分)。
本题解析:
试题分析:(1)该反应是吸热反应,温度升高,平衡正向移动,生成物浓度增大,反应物浓度减小,所以化学平衡常数增大;
(2)将体系中的C (s)全部移走,根据反应的可逆性,平衡会向左移动;
(3)A、单位体积内每消耗1 mol CO的同时生成1molH2,符合正逆反应速率相等,说明已达平衡,正确;B、该反应是混合气体的物质的量发生变化 的可逆反应,所以当混合气体总物质的量保持不变时证明已达平衡,正确;C、生成H2O(g)的速率与消耗CO的速率都表示逆反应速率,不能判断平衡是否到达,错误;D、H2O(g)、CO、H2的浓度相等的状态不一定是平衡状态,错误,答案选AB。
(4)①缩小容器的体积,压强增大,平衡逆向移动,CO的浓度减小,但最终仍比原来大,图像自t1时刻上方逐渐下降到原直线的上方后再保持不变;②降低温度,平衡逆向移动,CO的浓度减小到不变,图像在原来的位置一直下降至不变,如图
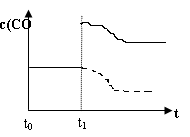
(5)根据lgK= -1.0,可得K=0.1,假设H2O(g)转化了x mol/L,依题意有:
C (s) + H2O(g)

CO (g) +H2 (g)
初始浓度(mol/L) 3.0 0 0
转化浓度(mol/L) x x x
平衡浓度(mol/L) 3.0 - x x x
所以K=x2/(3.0-x)=0.1,解得x=1/2,则水蒸气的转化率是1/2/3.0=16.7%;
(6)根据盖斯定律可知所求2C (s) + O2 (g) = 2CO2 (g)的△H= 2△H1+△H2-2△H3。
考点:考查化学平衡理论的应用,平衡常数的计算,盖斯定律的应用
本题所属考点:【热化学方程式】
本题难易程度:【困难】
A good man terminates a friendship with out rancour. 君子绝交不记仇.
 CO (g) +H2 (g),达到平衡时测得lgK= -1.0,求此温度下H2O(g)的
CO (g) +H2 (g),达到平衡时测得lgK= -1.0,求此温度下H2O(g)的 CO (g) +H2 (g) △H1
CO (g) +H2 (g) △H1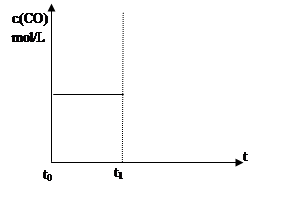
 CO (g) +H2 (g),达到平衡时测得lgK= -1.0,求此温度下H2O(g)的
CO (g) +H2 (g),达到平衡时测得lgK= -1.0,求此温度下H2O(g)的 CO (g) +H2 (g) △H1
CO (g) +H2 (g) △H1
 CO (g) +H2 (g)
CO (g) +H2 (g)