微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (11分)(1)已知:①Fe(s)+ O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
②2Al(s)+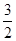 O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是 。
某同学认为,铝热反应可用于工业炼铁,你的判断是 (填“能”或“不能”),
你的理由是 。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,
如图所示。

①据图判断该反应是___(填“吸”或“放”)热反应,当反应达到平衡后,其他
条件不变,升高温度,逆反应速率将____(填“增大”、“减小”或“不变”)。
②其中B历程表明此反应采用的条件为________(填 字母)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)已知热化学方程式:H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为 。
填空题 (11分)(1)已知:①Fe(s)+ O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
②2Al(s)+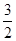 O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是 。
某同学认为,铝热反应可用于工业炼铁,你的判断是 (填“能”或“不能”),
你的理由是 。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,
如图所示。

①据图判断该反应是___(填“吸”或“放”)热反应,当反应达到平衡后,其他
条件不变,升高温度,逆反应速率将____(填“增大”、“减小”或“不变”)。
②其中B历程表明此反应采用的条件为________(填字母)。
A.升高温度 B.增大反应物的浓度
C.降低温度 &# 160; D.使用催化剂
(3)已知热化学方程式:H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为 。
本题答案:(11分)
(1)3FeO(s)+2Al(s)=Al2
本题解析:
试题分析:(1)根据盖斯定律Al与FeO的反应的热效应ΔH=②-3①=-1675.7 kJ·mol-1-3(-272.0 kJ·mol-1)=-859.7kJ/mol,所以该反应的热化学方程式为3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s) ΔH=-859.7 kJ·mol-1;该反应不能用于工业炼铁,因为用该反应炼铁时需消耗大量冶炼成本更高的Al,消耗大量能量,成本高,无经济效益;
(2)①该反应的反应物的总能量低于生成物的总能量所以是吸热反应;升高温度,正逆反应的速率都增大;②B的历程说明,没改变反应热,但降低了该反应的活化能,所以是使用了催化剂,答案选D;
(3)活化能是反应物的总能量与反应时的最高能量的差值,逆反应的反应物即正反应的生成物,所以逆反应的活化能=正反应的活化能+逆反应的反应热=167.2+241.8=409kJ/mol。
考点:考查盖斯定律的应用,活化能的计算
本题所属考点:【热化学方程式】
本题难易程度:【一般】
What colour do you like best?----Red. 你最喜欢的颜色是什么?---红色.