微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (12分)饮用水中含有一定浓度的NO3一将对人类健康产生危害,NO3一能氧化人体血红蛋白中的Fe(II),使其失去携氧功能。为了降低饮用水中NO3一的浓度,某兴趣小组提出如下方案:
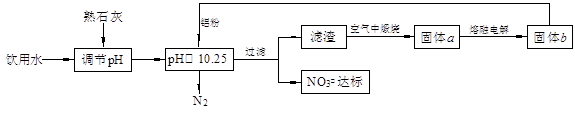
请回答下列问题:
(1)已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3一反应的离子方程式为 &# 160; 。
(2)该方案中选用熟石灰调节pH,理由是 、 ,在调节pH时,若pH过大或过小都会造成 的利用率降低。
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为 _。
(4)饮用水中的NO3-主要来自于NH4+。已知在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
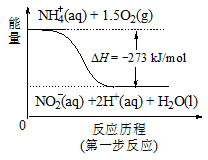
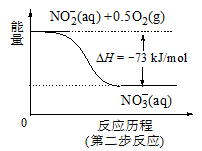
试写出1 mol NH4+ (aq)全部氧化成NO3-(aq)的热化学方程式是 。
填空题 (12分)饮用水中含有一定浓度的NO3一将对人类健康产生危害,NO3一能氧化人体血红蛋白中的Fe(II),使其失去携氧功能。为了降低饮用水中NO3一的浓度,某兴趣小组提出如下方案:

请回答下列问题:
(1)已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3一反应的离子方程式为 。
(2)该方案中选用熟石灰调节pH,理由是 、 ,在调节pH时,若pH过大或过小都会造成 的利用率降低。
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为 91EXAm.org_。
(4)饮用水中的NO3-主要来自于NH4+。已知在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:


试写出1 mol NH4+ (aq)全部氧化成NO3-(aq)的热化学方程式是 。
本题答案:(1)10Al + 6NO3- + 18H2O==10Al(
本题解析:
试题分析:(1)根据题意,在含有NO3-的碱性溶液中加入铝粉,会发生氧化还原反应,结合电子守恒、原子守恒及电荷守恒,可得反应的离子方程式为10Al + 6NO3- + 18H2O==10Al(OH)3 + 3N2↑+ 6OH-;(2)该方案中选用熟石灰调节pH,理由是引入的Ca2+对人体无害,而且熟石灰的来源丰富、价格便宜;在调节pH时,若pH过大或过小都会造成Al发生反应产生氢气,导致Al的利用率降低。(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,说明氧化产物是水,还原产物是N2,则催化还原法的离子方程式为5H2 + 2NO3 N2 + 4H2O + 2OH-;(4)根据图示可知1 mol NH4+ (aq)全部氧化成NO3-(aq)放出热量是346 kJ,所以该反应的热化学方程式是NH4+ (aq) + 2O2(g)==2H+(aq) + NO3- (aq) + H2O(l) △H=-346 kJ/mol。
N2 + 4H2O + 2OH-;(4)根据图示可知1 mol NH4+ (aq)全部氧化成NO3-(aq)放出热量是346 kJ,所以该反应的热化学方程式是NH4+ (aq) + 2O2(g)==2H+(aq) + NO3- (aq) + H2O(l) △H=-346 kJ/mol。
考点:考查含NO3-的污水的处理方法的离子方程式的书写、化学试剂的选择、热化学方程式的书写的知识。
本题所属考点:【热化学方程式】
本题难易程度:【困难】
Love lives in cottages as well as in courts. 爱情不分贫贱与富贵.