微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (14分)为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.煤综合利用的一种途径如下所示:

(1)已知:C(s)+H2O(g)====CO(g)+H2(g) △H1=+131.3kJ?mol-1
C(s)+2H2O(g)====CO2(g)+2H2(g) △H2=+90kJ?mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);ΔH
CH3OCH3(g)+3H2O(g);ΔH
①该反应平衡常数表达式为K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。
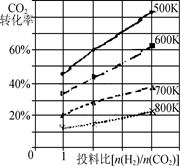
该反应的ΔH________(填“>”、“< 91EXAM.org;”或“=”)0。若温度不变,减小反应投料比[n(H2) /n(CO2)],则K将________(填“增大”、“减小”或“不变”)。
(3)一种新型氢氧燃料电池工作原理如下图所示。

①写出电极A的电极反应式 放电过程中,溶液中的CO32-将移向电极 (填A或B)
②以上述电池电解饱和食盐水,若生成0.2mol Cl2,则至少需通入O2的体积为 L(标准状况)
填空题 (14分)为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.煤综合利用的一种途径如下所示:

(1)已知:C(s)+H2O(g)====CO(g)+H2(g) △H1=+131.3kJ?mol-1
C(s)+2H2O(g)====CO2(g)+2H2(g) △H2=+90kJ?mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);ΔH
CH3OCH3(g)+3H2O(g);ΔH
①该反应平衡常数表达式为K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。

该反应的ΔH________(填“>”、“<”或“=”)0。若温度不变,减小反应投料比[n(H2) /n(CO2)],则K将________(填“增大”、“减小”或“不变”)。
(3)一种新型氢氧燃料电池工作原理如下图所示。

①写出电极A的电极反应式 放电过程中,溶液中的CO32-将移向电极 (填A或B)
②以上述电池电解饱和食盐水,若生成0.2mol Cl2,则至少需通入O2的体积为 L(标准状况)
本题答案:(每空2分,共14分)
(1)CO(g)+H2O(g)
本题解析:
试题分析:(1)根据盖斯定律得,一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为CO(g)+H2O(g)====CO2(g)+H2(g) △H=△H2-△H1=+90kJ?mol-1-131.3kJ?mol-1=-41.3kJ?mol-1;
(2)①根据平衡常数的定义,该来源:91考试网 91ExAm.org反应的平衡常数K= c(CH3OCH3)×c3(H2O)]/[c2(CO2)×c6(H2);
②根据图像可知,随温度升高,二氧化碳的转化率降低,说明升高温度,平衡逆向移动,所以正反应是放热反应,ΔH<0;平衡常数只与温度有关,若温度不变, 减小反应投料比[n(H2) /n(CO2)],则K将不变;
(3)①电极A通入氢气,发生氧化反应,所以A是负极,氢气失去电子,与碳酸根离子结合为水和二氧化碳气体,电极反应式为:H2-2e-+CO32-= CO2+ H2O;原电池中,阴离子向负极移动,则碳酸根离子向A极移动;
②生成0.2mol Cl2,则转移0.4mol电子,根据O2+4e-+2CO2=2CO32-,则需要氧气的物质的量是0.1mol,标准状况下的体积是0.1mol×22.4L/mol=2.24L。
考点:考查盖斯定律的应用,平衡常数的表示及判断,原电池反应原理的应用
本题所属考点:【热化学方程式】
本题难易程度:【困难】
A selfless man is upright and high-minded. 人不自私,顶天立地。