微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (10分)研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。在催化剂作用下,CO可用于合成甲醇:CO(g) + 2H2(g)  CH3OH(g)。
CH3OH(g)。
(1)若在恒温恒压的条件下,向密闭容器中充入4 mol CO和8 mol H2,合成甲醇,平衡时CO的转化率与温度、压强的关系如图所示:
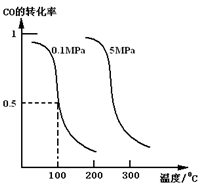
①该反应的正反应属于________反应(填“吸热”或“放热”)。
②在0.1 MPa、100 ℃的条件下,该反应达到平衡时容器内气体的物质的量为_________mol。
(2)若在恒温恒容的条件下,向上述平衡体系中充入4 mol CO,8 mol H2,与(1)相比,达到平衡时CO转化率_______(填“增大”,“不变”或“减小”), 平衡常数K_______(填“增大”,“不变”或“减小”)。
(3)在上述合成甲醇的反应中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:①CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH =" +206.2" kJ·mol-1
②CH4(g) + CO2(g) =" 2CO(g)" + 2H2(g) ΔH =" +247.4" kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。
填空题 (10分)研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。在催化剂作用下,CO可用于合成甲醇:CO(g) + 2H2(g)  CH3OH(g)。
CH3OH(g)。
(1)若在恒温恒压的条件下,向密闭容器中充入4 mol CO和8 mol H2,合成甲醇,平衡时CO的转化率与温度、压强的关系如图所示:

①该反应的正反应属于________反应(填“吸热”或“放热”)。
②在0.1 MPa、100 ℃的条件下,该反应达到平衡时容器内气体的物质的量为_________mol。
(2)若在恒温恒容的条件下,向上述平衡体系中充入4 mol CO,8 mol H2,与(1)相比,达到平衡时CO转化率_______(填“增大”,“不变”或“减小”), 平衡常数K_______(填“增大”,“不变”或“减小”)。
(3)在上述合成甲醇的反应中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:①CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH =" +206.2" kJ·mol-1
②CH4(g) + CO2(g) =" 2CO(g)" + 2H2(g) ΔH =" +247.4" kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。
本题答案:(1) ①放热 (2分) ②8
本题解析:
试题分析:(1) ①从图看出,压强不变时,温度越高转化率越低,说明升高温度平衡向逆向移动,故反应为放热反应。②在0.1 MPa、100 ℃的条件下CO的转化率为0.5,根据反应方程式:
CO(g) + 2H2(g)  CH3OH(g)。
CH3OH(g)。
n(起始)/ mol 4 8 0
n(变化)/ mol 2 4 2
n(平衡)/mol 2 4 2 所以平衡时气体总物质的量为8mol.
(2)反应是一个气体压强减小的反应,如果在恒温恒容的条件下反应,相对于(1)是减小了压强,平衡向逆向移动,CO的转化率减小。平衡常数只与温度有关,温度没有变,平衡常数不发生改变。 (3)将①×-②可得CH4和H2O(g)的反应方程式,则ΔH =206.2×2-247.4="+165.0" kJ·mol-1,故CH4和H2O(g)反应生成CO2和H2的热化学方程式为:CH4(g) + 2H2O(g) ="==" CO2(g) + 4H2(g) ΔH =" +165.0" kJ·mol-1
考点:化学平衡图像、化学平衡的移动和热化学方程式的计算。
本题所属考点:【热化学方程式】
本题难易程度:【困难】
He that has patience may compass anything. 有耐心的人事事做得到。