| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
(本小题14分)氮气是制备含氮化合物的一种重要物质,而含氮化合【热化学方程式】
 4NH3+3O2,通入N2的一极是________(填“阴极”或“阳极”),阳极的电极反应式是____ ____。 4NH3+3O2,通入N2的一极是________(填“阴极”或“阳极”),阳极的电极反应式是____ ____。(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应: ①N2(g)+3H2O(l)  2NH3(g)+ 2NH3(g)+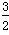 O2(g) ΔH=a kJ/mol。 O2(g) ΔH=a kJ/mol。已知:②N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol, 2NH3(g) ΔH=-92.4 kJ/mol,2H2(g)+O2(g)  2H2O(l) ΔH=-571.6 kJ/mol,则a=__________。 2H2O(l) ΔH=-571.6 kJ/mol,则a=__________。(4)已知:4NH3(g)+3O2(g)  2N2(g)+6H2O(g) ΔH=-1316 kJ·mol-1,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。 2N2(g)+6H2O(g) ΔH=-1316 kJ·mol-1,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。①当温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填代号)。  ②该燃料电池的负极反应式是____________________________________。 (5)工业上合成氨时,温度过高,氨气的产率降低,试从化学平衡移动原理的角度加以解释:__________________________________________________________________。 填空题 (本小题14分)氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛。 |
 4NH3+3O2,通入N2的一极是________(填“阴极”或“阳极”),阳极的电极反应式是____ ____。
4NH3+3O2,通入N2的一极是________(填“阴极”或“阳极”),阳极的电极反应式是____ ____。 2NH3(g)+
2NH3(g)+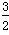 O2(g) ΔH=a kJ/mol。
O2(g) ΔH=a kJ/mol。 2NH3(g) ΔH=-92.4 kJ/mol,
2NH3(g) ΔH=-92.4 kJ/mol, 2H2O(l) ΔH=-571.6 kJ/mol,则a=__________。
2H2O(l) ΔH=-571.6 kJ/mol,则a=__________。 2N2(g)+6H2O(g) ΔH=-1316 kJ·mol-1,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
2N2(g)+6H2O(g) ΔH=-1316 kJ·mol-1,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
 2H2O(l) ΔH=-(92.4+a)×2÷3=—571.6 kJ/mol,则a=+765.0KJ/mol;(4) ①升高温度,正反应、逆反应的化学反应速率都加快,达到平衡所需要的时间缩短。所以甲错误;由于该反应的正反应是放热反应。根据平衡移动原理可知:升高温度,平衡逆向移动,达到平衡时NH3的转化率降低,乙错误;该反应的正反应是气体体积增大的反应,在其它条件不变时,增大压强,平衡向气体体积减小的逆反应方向移动,所以O2的转化率降低,错误。②该燃料电池的负极发生氧化反应,根据方程式可知NH3在反应中元素的化合价升高,失去电子,被氧化,因此在负极的电极反应式是2NH3-6e-+6OH-="==" N2↑+6H2O;(5)工业上合成氨时,温度过高,氨气的产率降低,这是由于合成氨的正反应是放热反应,升高温度,平衡向吸热反应方向移动,对该反应来说,平衡逆向移动,所以合成氨时,温度过高,氨气的产率降低。
2H2O(l) ΔH=-(92.4+a)×2÷3=—571.6 kJ/mol,则a=+765.0KJ/mol;(4) ①升高温度,正反应、逆反应的化学反应速率都加快,达到平衡所需要的时间缩短。所以甲错误;由于该反应的正反应是放热反应。根据平衡移动原理可知:升高温度,平衡逆向移动,达到平衡时NH3的转化率降低,乙错误;该反应的正反应是气体体积增大的反应,在其它条件不变时,增大压强,平衡向气体体积减小的逆反应方向移动,所以O2的转化率降低,错误。②该燃料电池的负极发生氧化反应,根据方程式可知NH3在反应中元素的化合价升高,失去电子,被氧化,因此在负极的电极反应式是2NH3-6e-+6OH-="==" N2↑+6H2O;(5)工业上合成氨时,温度过高,氨气的产率降低,这是由于合成氨的正反应是放热反应,升高温度,平衡向吸热反应方向移动,对该反应来说,平衡逆向移动,所以合成氨时,温度过高,氨气的产率降低。本题所属考点:【热化学方程式】
本题难易程度:【困难】
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:(18分)为减小CO2对环境的影响,.. | ||