微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (8分)二甲醚是一种重要的清洁燃料,有多种合成方法。
方法一:通过CH~OH分子间脱水制得:2CH3OH(g)=CH3OCH3(g)+H2O(g) ?H=-23.5 kJ/mol ①
(1)该反应在恒容密闭的容器中进行,能说明反应达到平衡的是_____。(填字母编号)
A.容器中压强不再变化
B.n(CH3OH):nCH3OCH3):n(H2O)="2:1:1"
C.c(CH3OH)=c(CH3OCH3)=c(H2O)
D.混合气体中各组分浓度不再变化
E.混合气体的平均相对分子质量不再变化
(2)在T℃时该反应的平衡常数K=5,若在此温度下某时刻 测定出该反应中各物质的浓度为c(CH3OH)="0.3" mol/L、c(CH3OCH3)="0.6" mol/L、c(H2O)=0.6mol/L,则此时正、逆反应速率的大小是V(正)____V(逆)。(填“>”、“<”或“=”
(3)3H2(g)+3CO(g)= CH3OCH3+3CO2(g) ?H=-a kJ/mol ②
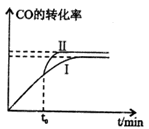
该反应在一定条件下的密闭容器中可达到平衡状态(曲线1),若在t0时刻改变一个条件,曲线I变为曲线Ⅱ,改变的条件是_________。(填字母编号)
A.升高温度
B.加入催化剂
C.缩小容器体积
D.增加H2的浓度
E.分离出二甲醚
(4)该反应可以分步进行:
4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g) △H3 ③
CO(g)+H2O(l)=CO2(g)+H2(g) △H4=-bKJ/mol ④
H2O(l)=H2O(g) △H5=+44KJ/mol ⑤
则反应③的焓变△H3=________KJ/mol(用含a、b的代数式表示)
填空题 (8分)二甲醚是一种重要的清洁燃料,有多种合成方法。
方法一:通过CH~OH分子间脱水制得:2CH3OH(g)=CH3OCH3(g)+H2O(g) ?H=-23.5 kJ/mol ①
(1)该反应在恒容密闭的容器中进行,能说明反应达到平衡的是_____。(填字母编号)
A.容器中压强不再变化
B.n(CH3OH):nCH3OCH3):n(H2O)="2:1:1"
C.c(CH3OH)=c(CH3OCH3)=c(H2O)
D.混合气体中各组分浓度不再变化
E.混合气体的平均相对分子质量不再变化
(2)在T℃时该反应的平衡常数K=5,若在此温度下某时刻测定出该反应中各物质的浓度为c(CH3OH)="0.3" mol/L、c(CH3OCH3)="0.6" mol/L、c(H2O)=0.6mol/L,则此时正、逆反应速率的大小是V(正)____V(逆)。(填“>”、“<”或“=”
(3)3H2(g)+3CO(g)= CH3OCH3+3CO2(g) ?H=-a kJ/mol ②
该反应在一定条件下的密闭容器中可达到平衡状态(曲线1),若在t0时刻改变一个条件,曲线I变为曲线Ⅱ,改变的条件是_________。(填字母编号)

A.升高温度
B.加入催化剂
C.缩小容器体积
D.增加H2的浓度
E.分离出二甲醚
(4)该反应可以分步进行:
4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g) △H3 ③
CO(g)+H2O(l)=CO2(g)+H2(g) △H4=-bKJ/mol ④
H2O(l)=H2O(g) △H5=+44KJ/mol ⑤
则反应③的焓变△H3=________KJ/mol(用含a、b的代数式表示)
本题答案:(1)D;(2)>;(3)C、D;(4)b - a +
本题解析:
试题分析:(1)A.由于反应前后气体的物质的量相等,所以在任何时刻气体的压强都不会发生变化,故不能判断反应达到平衡状态,错误;B.物质在反应反应时三种物质改变的物质的量的比2:1:1,但是这不能说明反应处于平衡状态,错误;C.CH3OCH3、H2O 都是生成物,二者的系数相等,因此在任何时刻都存在c(CH3OCH3)=c(H2O),而且c(CH3OH)= c(CH3OCH3)=c(H2O)时,反映可能处于平衡状态,也可能没有达到平衡,因此不能作为判断平衡的标志,错误;D.由于反应是在恒容的密闭容器内进行,若反应达到平衡状态,则反应体系内各种物质的量不变,由于容器的容积不变,所以混合气体中各组分浓度不再变化,正确;E.由于气体的质量不变,气体的物质的量不变,所以在任何时刻都存在混合气体的平均相对分子质量不变。因此不能作为判断平衡的标志,错误;(2)Qc=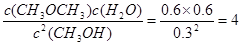 <5,说明反应还没有达到平衡,所以V正>V逆;曲线I变为曲线Ⅱ,反应速率加快,CO的转化率增大,说明平衡正向移动。A.升高温度,反应速率加快,但是平衡向吸热反应方向移动,由于正反应是放热反应,所以平衡逆向移动,CO的转化率减小,不符合题意,错误;B.加入催化剂,反应速率加快,但是平衡不发生移动,CO的转化率不变,与图像不符合,错误;C.缩小容器体积,物质的浓度增大,反应速率加快,由于正反应是气体体积减小的反应,所以增大压强,平衡正向移动,CO的转化率增大,符合题意,正确;D.增加H2的浓度,反应速率加快,可以使CO的转化率增大,符合题意,正确;E.分离出二 甲醚,即减小生成物的浓度,反应速率减小,平衡正向移动,CO的转化率增大,不符合题意,错误;(4)②—④+⑤,整理可得:4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g) △H3="(b" - a +44)KJ/mol;
<5,说明反应还没有达到平衡,所以V正>V逆;曲线I变为曲线Ⅱ,反应速率加快,CO的转化率增大,说明平衡正向移动。A.升高温度,反应速率加快,但是平衡向吸热反应方向移动,由于正反应是放热反应,所以平衡逆向移动,CO的转化率减小,不符合题意,错误;B.加入催化剂,反应速率加快,但是平衡不发生移动,CO的转化率不变,与图像不符合,错误;C.缩小容器体积,物质的浓度增大,反应速率加快,由于正反应是气体体积减小的反应,所以增大压强,平衡正向移动,CO的转化率增大,符合题意,正确;D.增加H2的浓度,反应速率加快,可以使CO的转化率增大,符合题意,正确;E.分离出二 甲醚,即减小生成物的浓度,反应速率减小,平衡正向移动,CO的转化率增大,不符合题意,错误;(4)②—④+⑤,整理可得:4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g) △H3="(b" - a +44)KJ/mol;
考点:考查反应平衡状态的判断、反应进行的方向、外界条件对平衡的影响、盖斯定律的应用的知识。
本题所属考点:【热化学方程式】
本题难易程度:【困难】
A good tongue is a good weapon. 会说话的舌头是一件精良的武器。