微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (15分)能 源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)氧化—还原法消除氮氧化物的转化: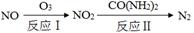
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
(3)某化学兴趣小组构想将NO转化为HNO3,装置如下图,电极为多孔惰性材料。则负极的电极反应式是 。

(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
①该反应平衡常数表达式为K= 。
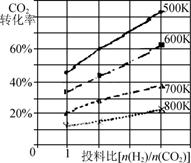
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的ΔH________(填“>”、“<”或“=”)0。
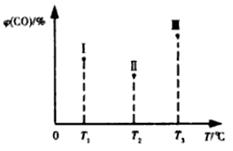
(5)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
填空题 (15分)能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)氧化—还原法消除氮氧化物的转化: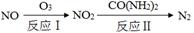
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
(3)某化学兴趣小组构想将NO转化为HNO3,装置如下图,电极为多孔惰性材料。则负极的电极反应式是 。

(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
①该反应平衡常数表达式为K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的ΔH________(填“>”、“<”或“=”)0。

(5)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。

本题答案:⑴①1(2分)②6NO2+4CO(NH2)2=7N2+8H2
本题解析:
试题分析:(1)氧化—还原法消除氮氧化物的转化: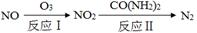
①标准状况下11.2L氧气的物质的量是0.5mol,则根据反应NO+O3=NO2+O2可知生成11.2 L O2时,消耗NO是0.5mol。氮元素的化合价从+2价升高到+4价,失去2个电子,所以转移电子的物质的量是0.5mol×2=1mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,根据原子守恒可知除了生成氮气外,还有CO2和水生成,所以反应的化学方程式是6NO2+4CO(NH2)2=7N2+8H2O+4CO2。
(2)已知:①NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1,②2SO2(g)+O2(g)
SO3(g)+NO(g) △H=-41.8 kJ·mol-1,②2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1,则根据盖斯定律可知②—①×2即可得到NO和O2反应生成NO2的热化学方程式2NO(g)+O2(g) = 2NO2(g) △H=-113.0 kJ/mol。
2SO3(g) △H=-196.6 kJ·mol-1,则根据盖斯定律可知②—①×2即可得到NO和O2反应生成NO2的热化学方程式2NO(g)+O2(g) = 2NO2(g) △H=-113.0 kJ/mol。
(3)原电池中负极失去电子,发生氧化反应,因此NO在负极通入失去电子转化为硝酸根,电极反应式是NO-3e-+2H2O=NO3-+4H+。
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
①化学平衡常数是在一定条件下,当可逆 反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知该反应平衡常数表达式为K=c(CH3OCH3)×c3(H2O)]/[c2(CO2)×c6(H2)。
②根据图像可知在投料比相同的条件下,升高温度CO2的转化率降低,这说明升高温度平衡向逆反应方向进行,所以正反应是放热反应,即该反应的ΔH<0。
(5)随着反应的进行CO逐渐被消耗,含量逐渐降低,当达到平衡状态以后CO的含量最低。由于正反应是放热反应,升高温度平衡向逆反应方向进行,所以CO的含量又逐渐增大。根据图像可知I、Ⅱ、Ⅲ三个容器中CO最高的是Ⅲ,最低的是Ⅱ,这说明温度由T1到T2时CO的含量降低,反应向正反应方向进行,即I一定没有达到平衡状态。温度由T2到T3时CO的含量升高,说明反应向逆反应方向进行,所以Ⅲ一定是平衡状态,而Ⅱ可能是平衡状态,所以一定达到化学平衡状态的是Ⅲ。温度低有利于CO的转化,所以若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是T1。
考点:考查氧化还原反应、盖斯定律、外界条件对平衡状态对影响和计算以及电极反应式等
本题所属考点:【热化学方程式】
本题难易程度:【困难】
The more we do, the more we can do; the more busy we are ,the more leisure we have. 事越做越能做,人越忙越有空.