|
|
|
(15分)(一)尿素又称碳酰胺,是含氮量最高的氮肥,工业上利用二【热化学方程式】
2016-12-27 00:20:49
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (15分)(一)尿素又称碳酰胺,是含氮量最高的氮 肥,工业上利用二氧化碳和氨气在一定条件下合成尿素。其反应分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1=" -330.0" kJ·mol-1 H2NCOONH4(氨基甲酸铵) (l) △H1=" -330.0" kJ·mol-1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2=" +" 226.3 kJ·mol-1 H2O(l)+H2NCONH2(l) △H2=" +" 226.3 kJ·mol-1
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 m3 密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②反应进行到10 min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)= mol/(L·min)。
③当反应在一定条件下达到平衡,若在恒温、恒容下再充入一定量气体He,则CO(NH2)2(l)的质量_______(填“增加”、“减小”或“不变”)。
(二)氨是制备尿素的原料,氨气溶于水得到氨水,在25℃下,将a mol/L的氨水与b mol/L的硫酸以3∶2体积比混合反应后溶液呈中性。用含a和b的代数式表示出氨水的电离平衡常数为_________。此溶液中各离子浓度由大到小的顺序为_________。
(三)氢气是合成氨的原料。“氢能”将是未来最理想的新能源。
(1)在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为 。
(2)氢气通常用生产水煤气的方法制得。其中C(s)+ H2O(g)  CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。 CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
①当加热到850℃反应达到平衡的标志有______________ 。
A.容器内的压强不变
B.消耗水蒸气的物质的量与生成CO的物质的量相等
C.混合气的密度不变
D.单位时间有n个H—O键断裂的同时有n个H—H键断裂
| ②x应满足的条件是 。
填空题 (15分)(一)尿素又称碳酰胺,是含氮量最高的氮肥,工业上利用二氧化碳和氨气在一定条件下合成尿素。其反应分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1=" -330.0" kJ·mol-1 H2NCOONH4(氨基甲酸铵) (l) △H1=" -330.0" kJ·mol-1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2=" +" 226.3 kJ·mol-1 H2O(l)+H2NCONH2(l) △H2=" +" 226.3 kJ·mol-1
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 m3 密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②反应进行到10 min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)= mol/(L·min)。
③当反应在一定条件下达到平衡,若在恒温、恒容下再充入一定量气体He,则CO(NH2)2(l)的质量_______(填“增加”、“减小”或“不变”)。
(二)氨是制备尿素的原料,氨气溶于水得到氨水,在25℃下,将a mol/L的氨水与b mol/L的硫酸以3∶2体积比混合反应后溶液呈中性。用含a和b的代数式表示出氨水的电离平衡常数为_________。此溶液中各离子浓度由大到小的顺序为_________。
(三)氢气是合成氨的原料。“氢能”将是未来最理想的新能源。
(1)在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为 。
(2)氢气通常用生产水煤气的方法制得。其中C(s)+ H2O(g)  CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。 CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
①当加热到850℃反应达到平衡的标志有______________ 。
A.容器内的压强不变
B.消耗水蒸气的物质的量与生成CO的物质的量相等
C.混合气的密度不变
D.单位时间有n个H—O键断裂的同时有n个H—H键断裂
|
②x应满足的条件是
。
本题答案:(15分,第(一)问①1分,其余每空2分)
(一)①二
本题解析:
试题分析:(一)①通过各组分的物质的量随时间变化关系图可知第二步反应较慢,总反应的反映速率由第二步决定;②V=0.50m3=500L,反应进行到10 min时测得CO2的物质的量是0.25mol,所以用CO2表示反应速率是V(CO2)="(1-0.25)mol÷500L÷10min=1." 5×10-4mol/(L?min);③当反应在一定条件下达到平衡,若在恒温、恒容下再充入一定量气体He,气体的浓度不变,则平衡不发生移动,CO(NH2)2(l)的质量不变;(二)氨是制备尿素的原料,氨气溶于水得到氨水,在25℃下,将a m ol/L的氨水与b mol/L的硫酸以3∶2体积比混合反应后溶液呈中性。n(NH3)=3amol;n(H+)=4bmol;NH3+H+=NH4+;根据电荷守恒可得n(H+)+n(NH4+)=n(OH-)+2n(SO42-),由于混合反应后溶液呈中性所以n(H+)= n(OH-)。故n(NH4+)= 2n(SO42-)=2×2b=4bmol;c(NH4+)=4bmol则在溶液中用含a和b的代数式表示出氨水的电离平衡常数为K="[(4b÷5)mol/L" ×10-7mol/L]÷[(3a-4b)÷5 mol/L]=4b×10-7/(3ª-4b)mol/L。此溶液中各离子浓度由大到小的顺序为c(NH4+)>c(SO42-)>c(H+)=c(OH-);(三)(1)在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为H2(g) +
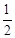
O2(g)=H2O(l)△H=-285.8 KJ/mol;(2)氢气通常用生产水煤气的方法制得。其中C(s)+ H2O(g)

CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。①A.由于该反应是反应前后气体体积不等的反应,若前后气体容器内的压强不变,则气体的物质的量不变,反应达到平衡,正确; B.在任何时刻都存在消耗水蒸气的物质的量与生成CO的物质的量相等 ,因此不能作为判断平衡的标志,错误;C.由于该反应是反应前后气体的质量改变的反应,若气体的混合气的密度不变,则反应处于平衡状态,正确;D.单位时间有2n个H—O键断裂的同时有n个H—H键断裂,则反应处于平衡状态,现在单位时间有n个H—O键断裂的同时有n个H—H键断裂,反应未达到平衡状态,错误;②运用三段式处理。假设反应过程中H2O 改变的浓度是amol/L,则产生的CO、H2的浓度也是amol/L,平衡时H2O的浓度是(6-a)mol/L,K=c(CO)c(H2)÷c(H2O)=a2÷(6-a)=1,解得a=2,由于可逆反应反应物不能完全转化为生成物,所以x应满足的条件是x>2。
考点:考查化学反应速率的计算、弱电解质电离平衡常数的计算、微粒浓度的大小比较、热化学方程式的书写、平衡状态的判断、物质的加入量的计算的知识。
本题所属考点:【热化学方程式】
本题难易程度:【困难】
He commands enough that obeys a wise man. 听从智者意见的人无需多问别人.
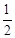 O2(g)=H2O(l)△H=-285.8 KJ/mol;(2)氢气通常用生产水煤气的方法制得。其中C(s)+ H2O(g)
O2(g)=H2O(l)△H=-285.8 KJ/mol;(2)氢气通常用生产水煤气的方法制得。其中C(s)+ H2O(g)  CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。①A.由于该反应是反应前后气体体积不等的反应,若前后气体容器内的压强不变,则气体的物质的量不变,反应达到平衡,正确; B.在任何时刻都存在消耗水蒸气的物质的量与生成CO的物质的量相等 ,因此不能作为判断平衡的标志,错误;C.由于该反应是反应前后气体的质量改变的反应,若气体的混合气的密度不变,则反应处于平衡状态,正确;D.单位时间有2n个H—O键断裂的同时有n个H—H键断裂,则反应处于平衡状态,现在单位时间有n个H—O键断裂的同时有n个H—H键断裂,反应未达到平衡状态,错误;②运用三段式处理。假设反应过程中H2O 改变的浓度是amol/L,则产生的CO、H2的浓度也是amol/L,平衡时H2O的浓度是(6-a)mol/L,K=c(CO)c(H2)÷c(H2O)=a2÷(6-a)=1,解得a=2,由于可逆反应反应物不能完全转化为生成物,所以x应满足的条件是x>2。
CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。①A.由于该反应是反应前后气体体积不等的反应,若前后气体容器内的压强不变,则气体的物质的量不变,反应达到平衡,正确; B.在任何时刻都存在消耗水蒸气的物质的量与生成CO的物质的量相等 ,因此不能作为判断平衡的标志,错误;C.由于该反应是反应前后气体的质量改变的反应,若气体的混合气的密度不变,则反应处于平衡状态,正确;D.单位时间有2n个H—O键断裂的同时有n个H—H键断裂,则反应处于平衡状态,现在单位时间有n个H—O键断裂的同时有n个H—H键断裂,反应未达到平衡状态,错误;②运用三段式处理。假设反应过程中H2O 改变的浓度是amol/L,则产生的CO、H2的浓度也是amol/L,平衡时H2O的浓度是(6-a)mol/L,K=c(CO)c(H2)÷c(H2O)=a2÷(6-a)=1,解得a=2,由于可逆反应反应物不能完全转化为生成物,所以x应满足的条件是x>2。