|
|
|
下列说法或表示方法正确的是A.等物质的量的硫蒸气和硫固体?【热化学方程式】
2016-12-27 00:25:00
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 下列说法或表示方法正确的是
A来源:91exam .org.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)=C(金刚石) 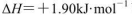 可知,金刚石比石墨稳定 可知,金刚石比石墨稳定
C.一定条件下,将0.5 mol N2(g)和1.5 molH2 (g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: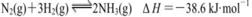
D.在稀溶液中, ,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ ,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
|
选择题 下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)=C(金刚石) 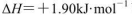 可知,金刚石比石墨稳定 可知,金刚石比石墨稳定
C.一定条件下,将0.5 mol N2(g)和1.5 molH2 (g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: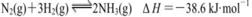
D.在稀溶液中, ,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ ,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
|
本题答案:D
本题解析:
试题分析:A.等质量的硫蒸气的能量比硫固体的能量高,所以等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量多,错误;B.石墨生成金刚石需要吸收能量,根据能量越低越稳定,石墨比金刚石稳定,错误;C.对可逆反应而言,反应物不能彻底进行,0.5 mol N2(g)和1.5 molH2 (g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,反应掉的氮气小于0.5mol,所以1mol氮气完全反应放热大于38.6kJ,错误;D.中和热是指强酸、强碱的稀溶液反应生成1mol水时放出的热量,浓硫酸在稀释过程中会放出大量的热,所以将含0.5
91ExAm.orgmolH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ,正确;选D。
考点:考查化学反应中的能量变化。
本题所属考点:【热化学方程式】
本题难易程度:【一般】
Who repairs not his gutters repairs his whole house. 今日不补沟,他日必补屋.