|
|
|
(16分)实现反应CH4(g)+CO2(g)<img src="http://www.91exam.org【燃烧热】
2016-12-27 01:31:40
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (16分)实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。
(1)已知:① 2CO(g)+O2(g)=2CO2(g) △H1=-566 kJ·mol-1
② 2H2(g)+O2(g)=2H2O(g) △H2=-484 kJ·mol-1
③ CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-802 kJ·mol-1
则△H0= kJ·mol-1
(2)在密闭容器中,通入2.5mol的CH4与2.5mol CO2,一定条件下发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图。 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图。
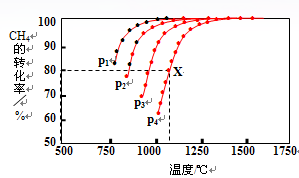
据图可知,p1、p2、 p3、p4由大到小的顺序 。
(3)C O和H2还可以通过反应C(s)+H2O(g) CO(g)+H2 (g) 制取。 CO(g)+H2 (g) 制取。
① 在恒温恒容下,若从反应物出发建立平衡,已达到平衡的是
| A.体系压强不再变化 | B.CO与H2的物质的量之比为1:1
| | C.混合气体的密度保持不变 | D.每消耗1mol H2O(g)的同时生成1mol H2
| ② 恒温下,在2L的密闭容器中同时投入四种物质,10min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2molH2(g)和2molC(s),反应的平衡常数K= 。
若此时增大压强,平衡将向 (填“正”、“逆”)反应方向移动,t1min时达到新的平衡。
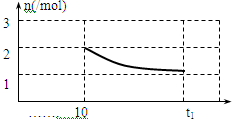
③ 请画出增大压强后10min~t1min时容器中H2物质的量n随时间变化的曲线图。
填空题 (16分)实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。
(1)已知:① 2CO(g)+O2(g)=2CO2(g) △H1=-566 kJ·mol-1
② 2H2(g)+O2(g)=2H2O(g) △H2=-484 kJ·mol-1
③ CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-802 kJ·mol-1
则△H0= kJ· mol-1
(2)在密闭容器中,通入2.5mol的CH4与2.5mol CO2,一定条件下发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图。 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图。

据图可知,p1、p2、 p3、p4由大到小的顺序 。
(3)CO和H2还可以通过反应C(s)+H2O(g) CO(g)+H2 (g) 制取。 CO(g)+H2 (g) 制取。
① 在恒温恒容下,若从反应物出发建立平衡,已达到平衡的是
| A.体系压强不再变化 | B.CO与H2的物质的量之比为1:1
|
| C.混合气体的密度保持不变 | D.每消耗1mol H2O(g)的同时生成1mol H2
|
② 恒温下,在2L的密闭容器中同时投入四种物质,10min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2molH2(g)和2molC(s),反应的平衡常数K=
。
若此时增大压强,平衡将向
(填“正”、“逆”)反应方向移动,t1min时达到新的平衡。
③ 请画出增大压强后10min~t1min时容器中H2物质的量n随时间变化的曲线图。

本题答案:(1)+248 (3分,无“+”不扣分) ;
(2)P
本题解析:
试题分析:(1)由盖斯定律,③-②-①得反应:CH4(g)+CO2(g)

2CO(g)+2H2(g) △H0:
故:△H0=△H3-△H2-△H1=-802 kJ?mol-1+484 kJ?mol-1+566 kJ?mol-1=+248kJ?mol-1。(2)①、由图像可知,相同条件下,p4、p3、p2、p1的CH4的转化率依次增大,又因为H4(g)+CO2(g)

2CO(g)+2H2(g)为气体分子数增加的反应,所以在温度不变的条件下,减压化学平衡正向移动,CH4的转化率增大,所以p4>p3>p2>p1。(3) 通过反应C(s)+H2O(g)

CO(g)+H2(g)制取CO和H2:①A、因为反应在恒温恒容条件下反应,而反应为气体分子数增加的反应,若化学反应不平衡,压强会增大,若体系压强不变,则可说明达到了平衡状态;故A正确。B、反应开始加入C(s)和H2O(g)可知反应完全正向建立平衡,由化学方程式可知生成的CO和H2的物质的量是相等的,也就是说任意时刻H2与CO的物质的量之比总为1:1,所以当H2与CO的物质的量之比为1:1时不能确定是否达到平衡状态;故B错误。C、由方程式可知该反应为固体生成气体的反应,随着反应的进行,气体的质量增加,但体积不变,所以密度增大,当气体密度不变时,则说明反应达到了平衡状态;故C正确。D、消耗1mol H2O(g)表示的为正反应速率,生成1mol H2表示的仍为正反应速率,无法确定正反应速率与逆反应速率是否相等,所以无法确定是否达到平衡。故D错误。综上所述可以说明反应达到平衡的为AC。②、恒温下,在2L的密闭容器中同时投入四种物质,10min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2molH2(g)和2molC(s),可得各气体物质的平衡浓度分别为:c(H2O)=1/2mol/L、c(CO)=1/2mol/L、c(H2)=1mol/L,则该反应的平衡常数:K=c(CO)×c(H2)/c(H2O)=1mol/L若此时加压,平衡向着气体分子数减小的方向即逆反应方向移动;③、在第10分钟时氢气的物质的量为2mol,随着化学反应的逆向移动,氢气的物质的量逐渐减小。但由于可逆反应不能进行到底,再次达平衡时氢气的物质的量应大于1mol。故图像为
考点:能正确书写热化学方程式,能根据盖斯定律进行有关反应热的简单计算。理解化学平衡和化学平衡常数的含义,能用化学平衡常数进行简单计算。理解浓度、温度、压强、催化剂等对化学平衡影响的一般规律。
点评:本题考查盖斯定律的计算、化学平衡状态的判断、化学平衡常数K的计算、化学平衡移动方向的判断等知识点。可逆反应在一定条件下是否达到平衡状态可从两个方面进行判断:一、是根据化学平衡状态的本质特征——正反应速率与逆反应速率相等(υ正=υ逆);二、是根据化学平衡状态的宏观表现——各组分的浓度(及与浓度相关的一些物理量如颜色、压强等)保持不变。
本题所属考点:【燃烧热】
本题难易程度:【困难】
No way is impossible to courage. 勇士面前无险路.


 2CO(g)+2H2(g) △H0:
2CO(g)+2H2(g) △H0: 2CO(g)+2H2(g)为气体分子数增加的反应,所以在温度不变的条件下,减压化学平衡正向移动,CH4的转化率增大,所以p4>p3>p2>p1。(3) 通过反应C(s)+H2O(g)
2CO(g)+2H2(g)为气体分子数增加的反应,所以在温度不变的条件下,减压化学平衡正向移动,CH4的转化率增大,所以p4>p3>p2>p1。(3) 通过反应C(s)+H2O(g) CO(g)+H2(g)制取CO和H2:①A、因为反应在恒温恒容条件下反应,而反应为气体分子数增加的反应,若化学反应不平衡,压强会增大,若体系压强不变,则可说明达到了平衡状态;故A正确。B、反应开始加入C(s)和H2O(g)可知反应完全正向建立平衡,由化学方程式可知生成的CO和H2的物质的量是相等的,也就是说任意时刻H2与CO的物质的量之比总为1:1,所以当H2与CO的物质的量之比为1:1时不能确定是否达到平衡状态;故B错误。C、由方程式可知该反应为固体生成气体的反应,随着反应的进行,气体的质量增加,但体积不变,所以密度增大,当气体密度不变时,则说明反应达到了平衡状态;故C正确。D、消耗1mol H2O(g)表示的为正反应速率,生成1mol H2表示的仍为正反应速率,无法确定正反应速率与逆反应速率是否相等,所以无法确定是否达到平衡。故D错误。综上所述可以说明反应达到平衡的为AC。②、恒温下,在2L的密闭容器中同时投入四种物质,10min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2molH2(g)和2molC(s),可得各气体物质的平衡浓度分别为:c(H2O)=1/2mol/L、c(CO)=1/2mol/L、c(H2)=1mol/L,则该反应的平衡常数:K=c(CO)×c(H2)/c(H2O)=1mol/L若此时加压,平衡向着气体分子数减小的方向即逆反应方向移动;③、在第10分钟时氢气的物质的量为2mol,随着化学反应的逆向移动,氢气的物质的量逐渐减小。但由于可逆反应不能进行到底,再次达平衡时氢气的物质的量应大于1mol。故图像为
CO(g)+H2(g)制取CO和H2:①A、因为反应在恒温恒容条件下反应,而反应为气体分子数增加的反应,若化学反应不平衡,压强会增大,若体系压强不变,则可说明达到了平衡状态;故A正确。B、反应开始加入C(s)和H2O(g)可知反应完全正向建立平衡,由化学方程式可知生成的CO和H2的物质的量是相等的,也就是说任意时刻H2与CO的物质的量之比总为1:1,所以当H2与CO的物质的量之比为1:1时不能确定是否达到平衡状态;故B错误。C、由方程式可知该反应为固体生成气体的反应,随着反应的进行,气体的质量增加,但体积不变,所以密度增大,当气体密度不变时,则说明反应达到了平衡状态;故C正确。D、消耗1mol H2O(g)表示的为正反应速率,生成1mol H2表示的仍为正反应速率,无法确定正反应速率与逆反应速率是否相等,所以无法确定是否达到平衡。故D错误。综上所述可以说明反应达到平衡的为AC。②、恒温下,在2L的密闭容器中同时投入四种物质,10min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2molH2(g)和2molC(s),可得各气体物质的平衡浓度分别为:c(H2O)=1/2mol/L、c(CO)=1/2mol/L、c(H2)=1mol/L,则该反应的平衡常数:K=c(CO)×c(H2)/c(H2O)=1mol/L若此时加压,平衡向着气体分子数减小的方向即逆反应方向移动;③、在第10分钟时氢气的物质的量为2mol,随着化学反应的逆向移动,氢气的物质的量逐渐减小。但由于可逆反应不能进行到底,再次达平衡时氢气的物质的量应大于1mol。故图像为