微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (14分)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍。又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)1 mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物反应生成两种盐和水,完全反应后消耗后者的物质的量为 。
(2)A、C、F间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(3)科学研究证明:化学反应热只与始终态有关,与过程无关。单质B的燃烧热为a kJ/mol。由B、C二种元素组成的化合物BC 14g完全燃烧放出热量b kJ,写出单质B和单质C反应生成BC的热化学方程式
;
(4)工业上在高温的条件下,可以用A 2C与BC反应制取单质A2。在等体积的I、II两个密闭容器中分别充入1 molA2C和1mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相等)。下列说法正确的是 。
A.达到平衡所需要的时间:I>II
B.达到平衡后A2C的转化率:I=II
C.达到平衡后BC的物质的量:I>II
D.达到平衡后A2的体积分数:I<II
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成化
合物的溶液中构成电池,则电池负极反应式为 。
填空题 (14分)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍。又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)1 mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物反应生成两种盐和水,完全反应后消耗后者的物质的量为 。
(2)A、C、F间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(3)科学研究证明:化学反应热只与始终态有关,与过程无关。单质B的燃烧热为a kJ/mol。由B、C二种元素组成的化合物BC 14g完全燃烧放出热量b kJ,写出单质B和单质C反应生成BC的热化学方程式
;
(4)工业上在高温的条件下,可以用A2C与BC反应制取单质A2。在等体积的I、II两个密闭容器中分别充入1 molA2C和1mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相等)。下列说法正确的是 。
A.达到平衡所需要的时间:I>II
B.达到平衡后A2C的转化率:I=II
C.达到平衡后BC的物质的量:I>II
D.达到平衡后A2的体积分数:I<II
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成化
合物的溶液中构成电池,则电池负极反应式为 。
本题答案:(14分)
(1)8 mol(3分)
(2) H
本题解析:
试题分析:F元素的最外层电子数是次外层电子数的0.75倍,则F的次外层电子数不可能是2,所以F元素有3层电子,次外层电子数是8,最外层电子数是6,所以F是S元素;C、F分别是同一主族元素,则C是O元素;又知B元素的最外层电子数是内层电子数的2倍,则B的内层电子数不可能是10,即B元素不可能是3层电子,所以内层电子数是2,则B元素是C元素;E元素的最外层电子数等于其电子层数,则E可能是H、Be、Al;它们的原子序数依次增大,所以E是Al元素;A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,D元素只能在F、Na、Mg中选择,若D是F,则与O元素的质子数之和是1 7,则A元素不存在;若D是Na,则A是H元素;若D是Mg,则A是He,不是主族元素,所以A是H元素,D是Na元素。
(1)1 mol由E、F二种元素组成的化合物Al2S3跟由A、C、D三种元素组成的化合物NaOH反应,生成两种盐,这两种盐是硫化钠和偏铝酸钠,则反应的化学方程式为Al2S3+8NaOH=4H2O+2NaAlO2+3Na2S,所以完全反应后消耗氢氧化钠的物质的量为8mol;
(2)A、C、F间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲是HS-,乙是OH-,二者反应生成硫离子和水,离子方程式是HS-+OH-=S2-+H2O;
(3)1molC固体完全燃烧生成二氧化碳放出的热量是akJ,热化学方程式为C(s)+ O2(g)=CO2(g);△H=" -a" kJ/mol,14gCO的物质的量是14g/28g/mol=0.5mol,则1molCO完全燃烧生成二氧化碳放出的热量是2bkJ,热化学方程式是CO(s)+ 1/2O2(g)=CO2(g);△H=" -2b" kJ/mol,所以两式相减,得C固体与氧气反应生成CO的热化学方程式,为C(s)+ 1/2O2(g)=CO(g);△H= -(a-2b) kJ/mol;
(4)工业制取氢气的化学方程式为CO+ H2O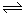 H2+CO2,该反应是气体物质的量不变的可逆反应,所以I与II是等效平衡。A、因为II的反应物的浓度是I的2倍,所以反应物浓度增大,反应速率加快,则到达平衡的时间:I>II,正确;B、因为通入的反应物的比是相同的,所以达到的平衡是等效平衡,达到平衡后A2C的转化率:I=II,正确;C、达到平衡后BC的物质的量,II是I的2倍,错误;D、达到平衡后A2的体积分数:I=II,错误,答案选AB;
H2+CO2,该反应是气体物质的量不变的可逆反应,所以I与II是等效平衡。A、因为II的反应物的浓度是I的2倍,所以反应物浓度增大,反应速率加快,则到达平衡的时间:I>II,正确;B、因为通入的反应物的比是相同的,所以达到的平衡是等效平衡,达到平衡后A2C的转化率:I=II,正确;C、达到平衡后BC的物质的量,II是I的2倍,错误;D、达到平衡后A2的体积分数:I=II,错误,答案选AB;
(5)C、Al、NaOH构成的原电池中,Al作负极,失去电子与氢氧化钠反应生成偏铝酸钠和水,所以负极的电极反应式为2Al+8OH- -6e-=2AlO2-+4H2O。
考点:考查元素的推断,物质的判断及性质应用,方程式的书写,电化学反应原理的应用
本题所属考点:【燃烧热】
本题难易程度:【困难】
The tongue is not steel,yet it cuts. 舌头非剑,但可伤人。