|
|
|
(15分)甲醇是一种可再生能源,具有广泛的开发和应用前景.【化学反应与能量】
2016-12-27 08:32:26
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
简答题 (15分)
甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) CH3OH(g)△H=-86.6kJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2:,反应达到平衡时,容器内的压强是开始时的3/5. CH3OH(g)△H=-86.6kJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2:,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为 。
②下列选项能判断该反应达到平衡状态的依据的有____ 。
| A.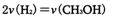 | B.CO的消耗速率等于CH3OH的生成速率
| | C.容器内的压强保持不变 | D.混合气体的密度保持不变
| E.混合气体的颜色保持不变� 91Exam.org0; F.混合气体的平均相对分子质量不随时间而变化
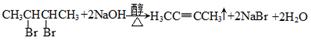 (3)已知在常温常压下: (3)已知在常温常压下:

(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为____
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.

电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为 。
简答题 (15分)
甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) CH3OH(g)△H=-86.6kJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2:,反应达到平衡时,容器内的压强是开始时的3/5. CH3OH(g)△H=-86.6kJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2:,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为 。
②下列选项能判断该反应达到平衡状态的依据的有____ 。
| A.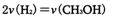 | B.CO的消耗速率等于CH3OH的生成速率
|
| C.容器内的压强保持不变 | D.混合气体的密度保持不变
|
E.混合气体的颜色保持不变 F.混合气体的平均相对分子质量不随时间而变化
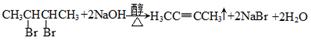
(3)已知在常温常压下:

(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为____
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.

电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为
。
本题答案:(15分)
(1)极性(2分)
(2)60%(2
本题解析:
试题分析:(1) 甲醇分子的正负电荷重心不重合,所以甲醇是极性分子;
(2)①:设消耗CO的物质的量为xmol,则CO(g)+2H2(g)

CH3OH(g)
开始时(mol) 1 2 0
消耗(mol) x 2x x
平衡时(mol)1-x 2-2x x
根据题意可得1-x+2-2x+x=3/5(1+2)
解得x=0.6
所以CO的转化率为0.6mol/1mol×100%=60%
②A、未指明正逆反应且比例关系不符合化学计量数之比,错误;B、CO的消耗速率等于CH3OH的生成速率,均是正反应速率,未达平衡也符合,错误;C、恒容条件下,该反应的气体压强开始时一直减小,达平衡时不再变化,正确;D、恒容条件下,气体的总质量不变,所以气体的密度始终不变,错误;E、该反应中的气体均无色,错误;F、气体的总质量不变,物质的量在减小,混合气体的平均相对分子质量在减小,达平衡时,混合气体的平均相对分子质量不再变化,正确,答案选CF。
(3)根据盖斯定律,目标方程式=1/2(①-②)+2×③,所以△H=1/2(b-a)-2c=(b-a-4c)/2;
(4)①燃料电池的负极是燃料发生氧化反应,结合电解质溶液,所以负极的电极反应式为
CH3OH-6e-+8OH-=CO32-+6H2O
②溶液中各离子的物质的量分别为:n(Cu2+)=0.1mol,n(Cl-)=0.4mol,电解开始时,阳极是氯离子放电生成氯气2Cl---2e-=Cl2↑,阴极是Cu2++2e-==Cu,当0.1molCu2+放电完毕后H+放电2H++2e-==H2↑,此时阳极生成0.1mol氯气;随后阴极和阳极产生的氢气和氯气的物质的量相等,只有氯离子放电完毕后,才有可能两极产生的气体体积相等。当氯离子放电完毕,OH-开始放电时两极产生的气体的物质的量分别是阳极:Cl2 0.2mol,阴极:H2 0.1mol;设当生成O2xmol时两极产生的气体相等,则阴极又产生H22xmol,所以0.2+x=0.1+2x,解得x=0.1mol,所以氧气得质量为3.2g;
考点:考查分子极性的判断,化学平衡的计算,盖斯定律的应用, 电化学原理的应用
本题所属考点:【化来源:91考试网 91ExAm.org学反应与能量】
本题难易程度:【困难】
Self-trust is the first secret of success. 自信是成功的首要秘诀.
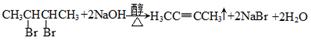 (3)已知在常温常压下:
(3)已知在常温常压下:

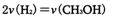
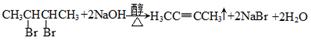 (3)已知在常温常压下:
(3)已知在常温常压下:

 CH3OH(g)
CH3OH(g)