|
|
|
已知:2CO(g)+O2(g)=2CO2(g) ΔH=" -56【化学反应与能量】
2016-12-27 09:36:19
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 已知:2CO(g)+O2(g)=2CO2(g) ΔH=" -566" kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ 1/2O2(g) ΔH=" -226" kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为566 kJ/mol
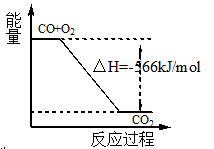
B.图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)ΔH>-452 kJ/mol
D.CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移的物质的量为为2 mol
|
91eXAm.org
选择题 已知:2CO(g)+O2(g)=2CO2(g) ΔH=" -566" kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ 1/2O2(g) ΔH=" -226" kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为566 kJ/mol
B.图可表示由CO生成CO2的反应过程和能量关系

C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)ΔH>-452 kJ/mol
D.CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移的物质的量为为2 mol
|
本题答案:CD
本题解析:
试题分析:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出热量;已知:2CO(g)+O2(g)=2CO2 (g)△H=-566kJ/mol;一氧化碳的燃烧热为283KJ/mol;故A错误;B、依据热化学方程式,2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol;分析图象中一氧化碳和氧气物质的量为1、
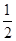
物质的量不符合反应物质的物质的量;故B错误;C、固体二氧化碳变化为气体二氧化碳需要吸热,焓变放热是负值;依据热化学方程式判断,2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-226kJ/mol;所以反应2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol,故C正确;D、已知:Na2O2(s)+CO2(g)=Na2CO3(s)+
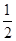
O2(g)△H=-226kJ/mol,若CO2(g)与Na2O2(s)反应放出452kJ热量,则参加反应的过氧化钠是2mol,所以电子转移的物质的量为为2 mol,故D正确,答案选CD。
点评:本题考查了,热化学方程式的书写方法和计算应用是解题关键,题目难度中
考点:考查热化学方程式的计算应用,燃烧热概念计算分析
本题所属考点:【化学反应与能量】
本题难易程度:【一般】
All are not hunters that blow the horn. 吹号角的未必都是猎人。
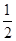 物质的量不符合反应物质的物质的量;故B错误;C、固体二氧化碳变化为气体二氧化碳需要吸热,焓变放热是负值;依据热化学方程式判断,2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-226kJ/mol;所以反应2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol,故C正确;D、已知:Na2O2(s)+CO2(g)=Na2CO3(s)+
物质的量不符合反应物质的物质的量;故B错误;C、固体二氧化碳变化为气体二氧化碳需要吸热,焓变放热是负值;依据热化学方程式判断,2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-226kJ/mol;所以反应2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol,故C正确;D、已知:Na2O2(s)+CO2(g)=Na2CO3(s)+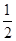 O2(g)△H=-226kJ/mol,若CO2(g)与Na2O2(s)反应放出452kJ热量,则参加反应的过氧化钠是2mol,所以电子转移的物质的量为为2 mol,故D正确,答案选CD。
O2(g)△H=-226kJ/mol,若CO2(g)与Na2O2(s)反应放出452kJ热量,则参加反应的过氧化钠是2mol,所以电子转移的物质的量为为2 mol,故D正确,答案选CD。