|
|
|
已知:2H2(g) +O2(g) = 2H2O(g) ΔH =-483.6 kJ/mol【化学反应与能量】
2016-12-27 09:40:52
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 已知:2H2(g) +O2(g) = 2H2O(g) ΔH =-483.6 kJ/mol
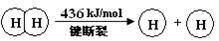
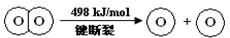
下列说法不正确的是
A.H2(g) 中的H—H 键比H2O(g) 中的H—O 键牢固
B.H2O(g)=H2(g) + 1/2O2(g)ΔH =" +241.8" kJ/mol
C.破坏1 mol H—O 键需要的能量是463.4 kJ
D.H2(g) + 1/2O2(g)=H2O(l)ΔH <-241.8 kJ/mol
|
选择题 ;已知:2H2(g) +O2(g) = 2H2O(g) ΔH =-483.6 kJ/mol

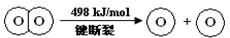
下列说法不正确的是
A.H2(g) 中的H—H 键比H2O(g) 中的H—O 键牢固
B.H2O(g)=H2(g) + 1/2O2(g)ΔH =" +241.8" kJ/mol
C.破坏1 mol H—O 键需要的能量是463.4 kJ
D.H2(g) + 1/2O2(g)=H2O(l)ΔH <-241.8 kJ/mol
|
本题答案:A
本题解析:
试题分析:A.2个氢分子中的H—H和1个氧分子中的O=O键断裂化学键吸收能量,形成2个水分子中的4个H—O键释放能量。由于该反应放出能量,说明反应物的总能量高于生成物,但是不能说H2(g) 中的H—H 键比H2O(g) 中的H—O 键牢固,错误;B.热化学方程式表示2mol的H2和1mol的O2发生反应产生2mol的气态水,会放出热量483.6 kJ ,则产生1mol的气态水放出热量是241.8KJ的能量,由于形成水和水分解是相反的过程,所以1mol的气态水分解产生1mol的H2(g) 和1/2molO2(g) 吸收热量是483.6 kJ,正确;C.破坏1 mol H—O 键需要的能量是463.4 kJ,正确;D.由于液态水含有的能量比气态水少,所以1mol的H2(g) 和 1/2mol的O2(g)反应产生1mol的液态H2O(l) 放出的热量大于241.8 kJ,所以 ΔH <-241.8 kJ/mo,正确。
考点:考查反应热与键能、物质的状态及物质的多少的关系的知识。
本题所属考点:【化学反应与能量】
本题难易程度:【一般】
Give a lie twenty-four hours start,and you can never overtake it. 让谎言早跑一天,你就别想追上。